Камни и минералы и самоцветные камни мира
Оксиды и гидрооксиды: Вольфрамит. Гюбнерит
 Диагностическая карта.
Диагностическая карта.
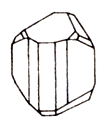
На фото. Образец
ферберита
(Панашкейра,
Португалия),
наиболее
богатого
железом
минерала
из группы
вольфрамита.
(Fe, Mn) W O4
Сингония моноклинная
Твердость
5-5,5
Удельный вес
7,14-7,54
Спайность
совершенная
Излом
неправильный
Цвет
красновато-коричневый, черно-коричневый
Цвет
в порошке
красновато-коричневый, черный
Блеск
полуметаллический, смоляной
Вольфрамит - вольфрамат железа и марганца. Блеск металлический, непрозрачен. Цвет черный или темно-коричневый. Черта черная до бурой. Излом неровный, хрупок. Спайность совершенная. Образуется в кварцевых жилых и грейзенах. Кристаллы (моноклинной сингонии) призматического габитуса, агрегаты - сплошные, плотные. Вольфрамит наряду с шеелитом представляет собой важнейшую руду вольфрама. Месторождения: в Китае, Бирме, США, Боливии, Португалии. Непрозрачный минерал красного или черного цвета, являющийся важнейшим сырьем для получения вольфрама.
Вольфрамит кристаллизуется в моноклинной сингонии. Кристаллы толсто таблитчатые, грани исштрихованы настолько, что сами кристаллы иногда кажутся состоящими из пластинок (псевдоморфозы). Цвет красновато-бурый, до черно-коричневого. Часто встречается в виде непрозрачных зернистых масс. В порошке имеет красновато-бурый цвет. Блеск полуметаллический, на поверхностях спайности смоляной. В кислотах не растворяется и практически не поддается окислению. Это очень тяжелый, твердый и хрупкий минерал. Термин "вольфрамит" употребляется для обозначения промежуточной по составу смеси (твердого сплава) трех металлов в изоморфном ряду от вольфрамата марганца (гюбнерит) до вольфрамата железа (ферберит). Очень тяжело разделять на фрации - радиоактивные примеси, процесс извлечения металлов идет с выделение свободных атомов кислорода и озона.
Химический состав - переменный; содержание WO4 до 76,6%; по количеству молекулы FeWO4 (в %) различаются: ферберит (100-80), собственно вольфрамит (80-20), гюбнерит (20- 0); отмечаются примеси железа, кальция, магния, ниобия (ниобаты), меди и др. Прозрачность - непрозрачный (ферберит) до полупрозрачного и прозрачного в тонких сколах (гюбнерит). Называют иногда "сухой гидрооксид" (задыхаются).
Сингония - моноклинная, призматический вид симметрии. Для гюбнерита характерны призматические удлиненные кристаллы, для вольфрамита - короткопризматические, ферберит вытянут вдоль [010] и уплощен по [100]. Главные простые формы: [100], [110], [102], [001], [010] и [011]. Часто встречаются двойники по [100] и [023]. На вертикальных гранях кристаллов наблюдается продольная штриховка. Распространены также радиально-лучистые, игольчатые агрегаты, сплошные массивные выделения разной степени зернистости. Спайность - совершенная по (010).
Диагностические признаки.
Вольфрамит можно спутать с некоторыми сульфидами и минералами группы колумбита. Последние отличаются спайностью, которая достаточно хорошо просматривается, и по тому, что хорошо окристаллизованный колумбит почти всегда находится в пегматитах. От сульфидов отличается при воздействии бисульфата калия и последующей обработке раствором серной кислоты с кусочками цинка. При этом получается великолепная синяя окраска. Цвет черты: у ферберита - темно-коричневая, у гюбнерита - желтая, желто-бурая
Происхождение.
Вольфрамит - типичный минерал пневматолитового генезиса (результат воздействия остаточных магматических растворов после кристаллизации гранитов). Флюиды (парогазовые смеси) внедряются в трещины застывающих окружающих пород и образуют кварцевые прожилки, в которых кристаллизуется и вольфрамит. Благодаря большому удельному весу и устойчивости к выветриванию, вольфрамит также накапливается в осадочных аллювиальных месторождениях, которые образуются из продуктов разрушения горных пород, переносящихся речными потоками и накапливающихся в аллювии (их часто ищут китайцы).
Месторождения.
Крупные месторождения располагаются на юге Китая (горная цепь Нань-Лин), в Австралии (Квинсленд), Боливии (район Ла-Пас), Канаде, США (Калифорния и Колорадо), Малайзии и Бирме. Кроме того, вольфрамит встречается на полуострове Корнуолл и в Камберленде (Великобритания), в Рудных Горах Саксонии и Богемии и в Португалии.
Применение.
Вольфрамит - основная руда на вольфрам; он содержит до 60% этого металла. Используется в металлургии; из вольфрама делают спирали электроламп, а его карбид используется для бурового и сверлильного инструмента и специальных сталей.






Гюбнерит (2-3,5 см) на друзе дымчатого кварца. Акчатау, Сев. Прибалхашье, Казахстан (СНГ). Фото: © А.А. Евсеев.
Mn WO4 - Fe-гюбнерит (вольфрамит) - руда вольфрама. Цвет - красновато-коричневый, черно-коричневый
Возможная псевдоморфоза вольфрамита по слюде мусковит (фото справа)

Гюбнерит (черные кр-лы до 2 см). Арсеньевское м-ние, Приморье, РФ (СНГ). Фото: © А.А. Евсеев.

Гюбнерит (вольфрамит - черный), кварц. Силвертон, шт. Колорадо, США. Фото: © А.А. Евсеев.

Гюбнерит. Рудник им. Джамбула, Кара-Оба, Центр. Казахстан (Средняя Азия, СНГ). Фото: © А.А. Евсеев.
В среднем за сутки в организм человека с пищей попадает около 0,001–0,015 мг вольфрама. Усвояемость вольфрама и его солей в желудочно-кишечном тракте человека составляет в среднем 1–10%, а слабо растворимой вольфрамовой кислоты – до 20%. Накопление вольфрама происходит в костях и почках (ломит кости и почки при его избытке). В костной ткани содержится 0,00025 мг/кг, в крови – 0,001 мг/л вольфрама. Выводится вольфрам из организма с мочой, а 75% его радиоактивного изотопа 185W – с калом. Молибден является антагонистом вольфрама. По свойствам вольфрам напоминает молибден, однако, в отличие от молибдена, вольфрам не является эссенциальным (концентрирующимся) элементом. При накоплении солей вольфрама снижается уровень мочевой кислоты и повышаются уровни ксантина и гипоксантина, что важно учитывать при подагре.
Хроническое поступление вольфрамовой пыли в организм может приводить к развитию клинического синдрома – "болезни тяжелых металлов" или пневмокониоза. Наиболее частыми симптомами являются кашель, нарушение дыхания, атопическая астма и изменения в легких. Проявление симптомов снижается после смены места работы или длительного отдыха, за счет прекращения контакта с металлом. В тяжелых случаях, при позднем диагностировании заболевания, может развиться патология "легочного сердца", фиброз легких и эмфизема.
ВОЛЬФРАМ, W (лат. Wolframium; * а. tungsten; н. Wolfram; ф. tungstene; и. tungsteno), - химический элемент VI группы периодической системы Менделеева, атомный номер 74, атомная масса 183,85. Природный вольфрам состоит из смеси пяти стабильных изотопов 180W(0,135%), 182W(26,41 %), 183W(14,4%), 184W(30,64%), 186W(28,41%). Открыт и выделен в виде вольфрамового ангидрида в 1781 шведским химиком К. Шееле. В 1783 испытали химики д'Элуяр выделили WO3 из вольфрамита и, восстановив его углеродом, получили чистый металл, названный ими вольфрам. Химический элемент, тугоплавкий металл светло-серого цвета, применяемый в различных сплавах, при изготовлении нитей накаливания в электрических лампочках, а также при производстве красок.
Вольфрам - тяжелый металл, светло-серый, тугоплавкий. Кристаллизуется в объемно- центрированной кубической решетке с периодом а=0,31647 нм (3,1647 Е). Плотность 19300 кг/ м3, t плавления 3410±20oС (после углерода самый тугоплавкий элемент), t кипения 5930oС. Теплопроводность [Вт/(м*К)] 129,89 (20oС); 108,94 (1300oС). Удельное электросопротивление (Ом*м) 5,5*10-4 (20oС); 90,4*10-4 (2700oС). Температурный коэффициент электрического сопротивления (0-170oС) 5,1*10-3 К-1. Важные свойства вольфрама: высокая электронная эмиссия при накаливании металла (мА/м2) - 1,5*10-6 (830oС); 2,3 (1630oС); 104 (1730oС); 298*104 (2230oС) и 1690*104 (2427oС); большая мощность излучаемой поверхностью металла энергии при высоких температурах (Вт/м2): 0,9*104 (800oС); 18,0*104 (1600oС); 64,0*104 (2200oС); 153,0*104 (2700oС); 245*104 (3030oС).
В соединениях степень окисления вольфрама может быть от +2 до +6. В высших степенях окисления он обладает кислотными свойствами, в низших - основными. Соединения низших ступеней окисления вольфрама относительно неустойчивы. Наиболее характерными и устойчивыми являются соединения вольфрама со степенью окисления +6. Вольфрам обладает большой склонностью к комплексообразованию. Металлический вольфрам в обычных условиях химически весьма стоек. С кислородом начинает взаимодействовать при температуре выше 400oС; противостоит действию воды, но при температуре красного каления легко окисляется водяным паром. Вольфрам на холоде практически не подвергается действию HCl, Н2SO4, HNO3 и HF любой концентрации, но легко растворяется в смеси HNO3 и HF. В отсутствие кислорода вольфрам не растворяется в щелочах и аммиаке. Важнейшие из соединений вольфрама: трехокись WO3, вольфрамовая кислота Н2WO4 и ее соли - вольфраматы.
Вольфрам мало распространен в природе; содержание в земной коре 1*10-4 % (по массе). В свободном состоянии не встречается. Образует собственные минералы (вольфраматы Ca, Fe, Mn, иногда Pb, Zn, редко оксиды WO3, Н2WO4, еще реже сульфиды WS2) или входит в виде изоморфной примеси в другие минералы, преимущественно в минералы Mo, Ti, а также в некоторые силикаты (слюды, полевые шпаты).
Наиболее важными минералами вольфрама являются вольфрамит и шеелит, которые могут образовываться и накапливаться до уровня промышленных концентраций в скарновом, грейзеновом и гидротермальном процессах. В природных минеральных парагенезисах вольфрам часто ассоциирует с Si, Mo, Sn, Be, Ta, F, реже - с Au, Sb, Hg. Формы миграции вольфрама в высокотемпературных рудоносных растворах представлены в основном гидроксо- и гидроксофторидными комплексами. Об основных генетических типах месторождений вольфрама и схемы обогащения см. в ст. Вольфрамовые руды. Получение чистого металла из вольфрамовых концентратов проводится в три этапа: химические выделение чистой вольфрамовой кислоты или ее солей; восстановление WO3 до металлического порошка; превращение порошка в металл.
Главная область применения вольфрама - производство сталей (около 85% добычи). Чистый вольфрам применяется для изготовления нитей накаливания электроламп, спиралей нагревателей в электрических печах, электродов, различных деталей для высоковакуумных и рентгеновских приборов, при атомно-водородной сварке. По материалам: http://www.mining-enc.ru