Сурьма - ядовитый металл (полуметалл),
используемый в металлургии, медицине и технике
Токсические и ядовитые камни и минералы
 Сурьма (латинское Stibium, обозначается символом Sb) - элемент с атомным номером 51 и атомным весом 121,75. Является элементом главной подгруппы пятой группы, пятого периода периодической системы химических элементов Д.И. Менделеева. Сурьма - металл (полуметалл) серебристо-белого цвета с синеватым оттенком, грубозернистого строения. В обычном виде образует кристаллы, обладающие металлическим блеском и имеющие плотность 6,68 г/см3.
Сурьма (латинское Stibium, обозначается символом Sb) - элемент с атомным номером 51 и атомным весом 121,75. Является элементом главной подгруппы пятой группы, пятого периода периодической системы химических элементов Д.И. Менделеева. Сурьма - металл (полуметалл) серебристо-белого цвета с синеватым оттенком, грубозернистого строения. В обычном виде образует кристаллы, обладающие металлическим блеском и имеющие плотность 6,68 г/см3.
Напоминая по внешнему виду металл, кристаллическая сурьма отличается хрупкостью и хуже проводит тепло и электрический ток, чем обычные металлы. В природе известны два стабильных изотопа 121Sb (изотопная распространенность 57,25%) и 123Sb (42,75%). На фото - Сурьма. Округ Туларе, шт. Калифорния. США. Фото: © А.А. Евсеев.
C сурьмой человечество знакомо издревле: в странах Востока она употреблялась примерно за 3000 лет до н. э. для изготовления сосудов. Соединение сурьмы - сурьмяный блеск (природный Sb2S3) применяли для окраски в черный цвет бровей и ресниц. В Древнем Египте порошок из этого минерала назывался mesten или stem, для древних греков сурьма была известна под именем stími и stíbi, отсюда латинский stibium.
Металлическая сурьма в виду своей хрупкости применяется редко, однако в связи с тем, что она увеличивает твердость других металлов (олова, свинца) и не окисляется при обычных условиях, металлурги нередко вводят ее в качестве легирующего элемента в состав различных сплавов. Сплавы с использованием пятьдесят первого элемента применяются широко в самых различных областях: для аккумуляторных пластин, типографских шрифтов, подшипников (баббиты), экранов для работы с источниками ионизирующих излучений, посуды, художественного литья и т. п.
Чистую металлическую сурьму в основном используют в полупроводниковой промышленности - для получения антимонидов (солей сурьмы) с полупроводниковыми свойствами. Сурьма входит в состав лекарственных синтетических препаратов. Широкое применение нашли и соединения сурьмы: сульфиды сурьмы используются при производстве спичек и в резиновой промышленности. Оксиды сурьмы применяются при производстве огнеупорных соединений, керамических эмалей, стекла, красок и керамических изделий.
Сурьма относится к микроэлементам (содержание в организме человека 10–6% по массе). Известно, что сурьма образует связи с атомами серы, что обусловливает ее высокую токсичность. Сурьма проявляет раздражающее и кумулятивное действие, накапливается в щитовидной железе, угнетая ее функцию и вызывая эндемический зоб. Пыль и пары вызывают носовые кровотечения, сурьмяную "литейную лихорадку", пневмосклероз, поражают кожу, нарушают половые функции. Тем не менее, еще с древних времен соединения сурьмы применяются в медицине как ценные лекарственные средства.
Биологические свойства
Сурьма относится к микроэлементам, она обнаружена во многих живых организмах. Установлено, что содержание пятьдесят первого элемента (на сто грамм сухого вещества) составляет в растениях 0,006 мг, в морских животных 0,02 мг, в наземных животных 0,0006 мг. В человеческом организме содержание сурьмы всего 10–6% по массе. Поступление пятьдесят первого элемента в организм животных и человека происходит через органы дыхания (с вдыхаемым воздухом) или желудочно-кишечный тракт (с пищей, водой, медикаментами), среднесуточное поступление составляет около 50 мкг. Основными депо накопления сурьмы являются щитовидная железа, печень, селезенка, почки, костная ткань, также происходит накопление в крови (в эритроцитах накапливается преимущественно сурьма в степени окисления +3, в плазме крови - в степени окисления +5).
Выделяется металл из организма достаточно медленно главным образом с мочой (80%), в незначительном количестве - с фекалиями. Однако физиологическая и биохимическая роль сурьмы до сих пор неизвестна и изучена слабо, поэтому данные о клинических проявлениях дефицита сурьмы отсутствуют.
Однако известны данные о предельно допустимых концентрациях элемента для человеческого организма: 10-5-10-7 грамм на 100 грамм сухой ткани. При более высокой концентрации сурьма инактивирует (препятствует работе) ряд ферментов липидного, углеводного и белкового обмена (возможно в результате блокирования сульфгидрильных групп).
Дело в том, что сурьма и ее производные токсичны - Sb образует связи с серой (например, реагирует с SH-группами ферментов), что обусловливает ее высокую токсичность. Накапливаясь с избытком в щитовидной железе, сурьма угнетает ее функцию и вызывает эндемический зоб. При попадании в пищеварительный тракт сурьма и ее соединения не вызывают отравления, так как соли Sb (III) гидролизуются с образованием малорастворимых продуктов, которые выводятся из организма: наблюдается раздражение слизистой желудка, наступает рефлекторная рвота, причем почти все количество принятой сурьмы выбрасывается вместе с рвотными массами.
Однако после приемов значительных количеств сурьмы или при длительном ее применении могут наблюдаться поражения желудочно-кишечного тракта: язвы, гиперемия, набухание слизистой. Cоединения сурьмы (III) более токсичны, чем сурьмы (V) - биодоступны. Порог восприятия привкуса в воде - 0,5 мг/л. Смертельная доза для взрослого человека - 100 мг, для детей - 49 мг. ПДК Sb в почве 4,5 мг/кг.
В воде сурьма относится ко второму классу опасности, имеет ПДК 0,005 мг/л, установленное по санитарно-токсикологическому ЛПВ. В природных водах норматив составляет 0,05 мг/л. В сточных промышленных водах, сбрасываемых на очистные сооружения, имеющие биофильтры, содержание сурьмы не должно превышать 0,2 мг/л.
Пыль и пары вызывают носовые кровотечения, сурьмяную "литейную лихорадку", пневмосклероз, поражают кожу, нарушают половые функции. Для аэрозолей сурьмы ПДК в воздухе рабочей зоны 0,5 мг/м3, в атмосферном воздухе 0,01 мг/м3. При втирании в кожу сурьма вызывает раздражение, эритемы, пустулы, подобные оспенным.
Подобного рода повреждения могут наблюдаться в профессиях, имеющих дело с сурьмой: у эмалировщиков (применение окиси сурьмы), у печатников (работа с печатными сплавами, британский металл). При хронической интоксикации организма сурьмой необходимо принять профилактические меры, ограничить ее поступление, провести симптоматическое лечение, возможно использование комплексообразователей.
Тем не менее, несмотря на отрицательные факторы, связанные с токсичностью сурьмы, она, как и ее соединения применяется в медицине. Еще в XV-XVI вв. препараты сурьмы применяли как лекарственные средства, главным образом как отхаркивающие и рвотные. Чтобы вызвать рвоту, пациенту давали вино, выдержанное в сурьмяном сосуде. Одно из соединений сурьмы, KC4H4O6(SbO) * H2O, так и называется рвотным камнем. Механизм действия такого препарата описан нами выше.

Сурьма. Монарх р-к (Sb), Гравелотт, Лимпопо пров. Ю. Африка. Фото: © А.А. Евсеев.
Cоединения сурьмы применяются в медицине как лекарственные средства для лечения паразитических болезней (сурьма обладает паразитотропным действием) человека и животных (сонной болезни, распространяемой мухами це-це; кала-азара, или тропической спленомегалии - увеличение селезенки; филяриозов, вызываемых нитевидным червем, живущим в лимфатической системе). В последнее время делаются попытки применения препаратов сурьмы при сифилисе, подобно новарсенолу. Cурьма вводится в вену (необходима осторожность).
Интересные факты
Один из современнейших методов "использования" сурьмы поступил на вооружение криминалистов. Дело в том, что пуля нарезного оружия оставляет за собой (трассирующий) вихревой поток - "след", в котором имеются доли ряда элементов - свинца, сурьмы, бария, меди. Оседая, они оставляют на поверхности невидимый "отпечаток".
Однако невидимыми эти частицы были лишь до недавнего времени, современные разработки позволяют определить наличие частиц и направление полета пули. Происходит это следующим образом: на поверхность накладывают полоски влажной фильтровальной бумаги, затем их помещают в ускоритель элементарных частиц (синхрофазатрон) и подвергают бомбардировке нейтронами. В результате "обстрела" часть атомов, перешедших на бумагу (в том числе атомы сурьмы), переходят в нестойкие радиоактивные изотопы, а степень их активности позволяет судить о содержании этих элементов в пробах и таким образом определить траекторию и длину полета пули, характеристику пули, оружия и боеприпасов.
Многие полупроводниковые материалы, содержащие сурьму, получены в условиях невесомости на борту околоземной космической орбитальной научной станции "Салют-6" и "Скайлэб".
Автор "Похождений бравого солдата Швейка" в рассказе "Камень жизни" излагает одну из версий происхождения названия "антимоний". В 1460 году настоятель Штальгаузенского монастыря в Баварии отец одного монастыря искал философский камень (амальгаму золота и рути – "белое золото", выпаривал до золота). В те далекие времена вряд ли удалось бы отыскать хоть один монастырь, в кельях и подвалах которого не шла бы алхимическая работа (Испания, г. Альмаден, крупнейшее в мире месторождение промышленной красной киновари – сульфида ртути, спутника месторождений сурьмы, сухая вулканическая возгонка на раскаленных батолитах). На фото ниже – месторождения типа "киноварь" и киноварь – спутник сурьмы в местрождениях.

Черный антимонит – сульфид сурьмы, со спутниками – серый халцедон
и красная киноварь в друзе, Никитовка, Донецкая обл., юго-восток Украины
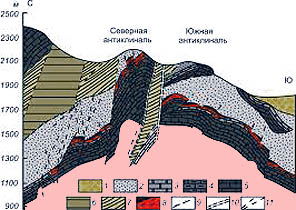

В одном из опытов игумен смешал в тигле пепел Жанны Д'Арк ("Орлеанской Девственницы" – гордости Франции) с пеплом и двойным количеством земли, взятой с места сожжения (киноварь). Эту "адскую смесь" монах стал нагревать. После упаривания с углем получилось тяжелое темное вещество с металлическим блеском (ртуть). Результат огорчил настоятеля - в книге говорилось о том, что заветный "философский камень" должен быть невесом и прозрачен (ошибки перевода – дорогим и залотистого цвета).
Разочаровавшись в "еретической науке", Леонардус выбросил полученное вещество на монастырский двор (с огарками - антимонитом). Вскоре он заметил, что свиньи охотно лижут выброшенный им "камень" (огарок) и быстро жиреют. Решив, что им открыто питательное вещество, которым можно накормить голодных, монах приготовил новую порцию "камня жизни", растолок его и этот порошок добавил в кашу, которой питались его тощие братья во Христе. На следующий день сорок монахов монастыря умерли в страшных мучениях. Раскаиваясь в содеянном, настоятель проклял опыты, а "камень жизни" переименовал в антимониум, то есть средство "против монахов". За достоверность рассказа ручаться не стоит, так же, как и за автора данной версии.
Химики средневековья Западной Европы (Испания) обнаружили, что в расплавленной сурьме часто растворяются почти все металлы (элемент "философского камня-II" – после ртути и ее амальгам). Сурьма - металл, пожирающий другие металлы, - "химический хищник". Может быть, подобные рассуждения и привели к символическому изображению сурьмы в виде фигуры волка с открытой (разверстой) пастью (ожоги химического производства сурьмы - "Адские или Дьяволовы пасти" г. Альмаден, Испания, Католической церкви Его Величества Короля Испании).
В арабской литературе свинцовый и сурьмяный блеск называли аль-каххаль (грим), алко(г)оль, алкофоль. Считалось, что косметические и лечебные средства для глаз содержат в себе таинственный дух (джинн), отсюда, вероятно, алкоголем стали называть летучие жидкости.
Всем знакомо выражение "насурьмянить брови" (наложение грима на лицо), которое ранее обозначало косметическую операцию с использованием порошка сернистой сурьмы Sb2S3. Дело в том, что соединения сурьмы имеют разную расцветку: одни черного цвета, другие - оранжево-красного. Еще в незапамятные времена арабы торговали в странах Востока краской для подведения бровей, в составе которой находилась сурьма. Автор романа "Самвел" подробно описывает технику этой косметической операции: "Юноша достал из-за пазухи кожаную сумочку, взял тонкую заостренную золотую палочку, поднес к губам, подышал на нее, чтобы она сделалась влажной, и опустил в порошок. Палочка покрылась тонким слоем черной пыли. Он начал накладывать сурьму на глаза". Во время археологических раскопок древних захоронений на территории Армении были обнаружены все выше описанные косметические принадлежности: тонкая заостренная золотая палочка и крохотная шкатулка из полированного мрамора (кража на Ваке в Испании, средние века, Западная Европа).
История
Имя открывателя сурьмы неизвестно, так как этот металл известен человеку с доисторических времен. Изделия из сурьмы и ее сплавов (в частности, сурьмы с медью) использовались человеком на протяжении многих тысячелетий, сурьмяная бронза, употреблявшаяся в период Вавилонского царства, состояла из меди и добавок олова, свинца и сурьмы. Археологические находки подтвердили предположения о том, что в Вавилоне еще за 3 тысячи лет до н.э. (совместно с ее геологическим спутником – красной киноварью) из сурьмы делали сосуды, например, хорошо известно описание фрагментов вазы из металлической сурьмы, найденной в Телло (южная Вавилония). Обнаружены и другие предметы из сурьмы, в частности в Грузии, датируемые I тысячелетием до н. э. Для изготовления изделий использовались и сплавы сурьмы со свинцом, и необходимо отметить, что в древности металлическая сурьма не считалась самостоятельным металлом, и ее принимали за свинец (имитатора переходной химической производственной формы ртути – афродизиака для женщин).
Что касается соединений сурьмы, то наиболее известен "сурьмяный блеск" - сернистая сурьма Sb2S3, которая была известна во многих странах. В Индии, Междуречье, Египте, Средней Азии и других азиатских странах из этого минерала делали тонкий блестящий черный порошок, применявшийся для косметических целей, особенно для гримировки глаз "глазная мазь". Плиний Старший называет сурьму stimmi и stibi - косметические и фармацевтические средства для гримирования и лечения глаз. В греческой литературе Александрийского периода эти слова означают косметическое средство черного цвета (черный порошок).
Что касается русского слова "сурьма", то, вероятнее всего, оно имеет тюркское происхождение - surme. Первоначальное значение этого термина было - мазь, грим, притирание. Это подтверждается сохранением до нашего времени данного слова во многих восточных языках: турецком, фарсидском, узбекском, азербайджанском и других. По другим данным, "сурьма" происходит от персидского "сурме" - металл. В русской литературе начала XIX века употребляются слова сурьмяк (Захаров, 1810), сюрма, сюрьма, сюрмовой королек и сурьма.
Нахождение в природе
Несмотря на то, что содержание сурьмы в земной коре сравнительно невелико - среднее содержание (кларк) 5∙10-5% (500 мг/т) - она была известна в глубокой древности. Это не удивительно, ведь сурьма входит в состав примерно ста минералов, самый распространенный из которых сурьмяный блеск Sb2S3 - минерал свинцово-серого цвета с металлическим блеском (он же антимонит, он же стибнит), содержащий более 70% сурьмы и служащий основным промышленным сырьем для ее получения. Основная масса сурьмяного блеска образуется в гидротермальных месторождениях, где его скопления создают залежи сурьмяной руды в форме жил и тел пластообразной формы. В верхних частях рудных тел, близ поверхности земли, сурьмяный блеск подвергается окислению, образуя ряд минералов, а именно: сенармонтит и валентит Sb2O3 (оба минерала одного и того же химического состава, содержат 83,32% сурьмы и 16,68% кислорода); сервантит (сурьмяная охра) Sb2O4; стибиоканит Sb2O4∙nH2O; кермезит Sb2S2O. В редких случаях сурьмяные руды (благодаря сродству с серой) представлены сложными сульфидами сурьмы, меди, ртути, свинца, железа (бертьерит FeSbS4, джемсонит Pb4FeSb6S14, тетраэдрит Cu12Sb4S13, ливингстонит HgSb4S8 и другие), а также окислами и оксихлоридами (сенармонтит, надорит PbClSbO2) сурьмы.
Содержание сурьмы в изверженных эффузивных породах ниже, чем в осадочных породах (вулканическая возгонка по трещинам от раскаленной магмы на катализаторе из кальдеры - воде). В осадочных наиболее высокие концентрации сурьмы отмечаются в глинистых сланцах (1,2 г/т), бокситах и фосфоритах (2 г/т) и самые низкие в известняках и песчаниках (0,3 г/т). Повышенные количества сурьмы установлены в золе углей (конфликтует водой с киноварью – киноварь формируется на мышьяке).
В природных соединениях сурьма с одной стороны проявляет свойства металла и является типичным халькофильным элементом, образуя антимонит. В тоже время, сурьма обладает свойствами металлоида, проявляющимися в образовании различных сульфосолей - буланжерита, тетраэдрита, бурнонита, пираргирита и прочих. С рядом металлов (палладий, мышьяк) сурьма способна создавать интерметаллические соединения. Кроме того, в природе наблюдается изоморфное замещение сурьмы и мышьяка в блеклых рудах и геокроните Pb5(Sb, As)2S8 и сурьмы и висмута в кобеллите Pb6FeBi4Sb2S16 и др.
Стоит отметить, что сурьма встречается и в самородном состоянии. Самородная сурьма - минерал состава Sb, иногда с незначительной примесью серебра, мышьяка, висмута (до 5%). Встречается в виде зернистых масс (кристаллизующихся в тригональной системе), натечных образований и ромбоэдрических пластинчатых кристаллов.
Самородная сурьма имеет металлический блеск, оловянно-белый цвет с желтой побежалостью. Образуется при дефиците серы в низкотемпературных сурьмяных, сурьмяно-золото-серебряных и медно-свинцово-цинково-сурьмяно-серебряно-мышьяковых, а также высокотемпературных пневматолитово-гидротермальных сурьмяно-серебро-вольфрамовых месторождениях (в последних содержание сурьмы может достигать кристаллических значений - Сейняйоки в Финляндии – кристаллический щит сурьмы).
Содержание сурьмы в пластовых рудных телах от 1 до 10%, в жильных - от 3 до 50%, среднее содержание - от 5 до 20%, порою более. Пластовые рудные тела образуются при посредстве низкотемпературных гидротермальных растворов путем заполнения трещин в горных породах, а также вследствие замещения последних минералами сурьмы. Основное промышленное значение имеют два типа месторождений: пластовые тела, линзы, гнезда и штокверки в выдержанных плащеобразных залежах, образующихся в результате метасоматического замещения кремнеземом и соединениями сурьмы известняков под сланцевым экраном (в Китае - Сикуаншань, в СНГ - Кадамджай, Терексай, Джижикрут в Средней Азии). Второй тип месторождений - системы крутопадающих секущих кварцево-антимонитовых жил в сланцах (в СНГ - Тургайское, Раздольнинское, Сарылах и др.; в Южной Африке - Гравелот и др.). Третье – вертикальные трещины (Донецкая обл., юго-восток Украины, Никитовка). Богатые месторождения сурьмяных минералов обнаружены на территории Китая, Боливии, Японии, США, Мексики, ряда африканских стран.
Применение
В связи с хрупкостью металлическая сурьма применяется редко, но, так как она увеличивает твердость других металлов (например, олова и свинца) и не окисляется при обычных условиях, металлурги вводят ее в состав различных сплавов. Общее число сплавов, содержащих пятьдесят первый элемент, приближается к двумстам. Легирование ряда сплавов сурьмой было известно еще в средние века: "Если путем сплавления определенная порция сурьмы прибавляется к олову, получается типографский сплав (гарт), из которого изготовляется шрифт, применяемый теми, кто получает книги".
Невероятно, но такой сплав - гарт (с укр. яз. – "закалка", - сурьма, олово и свинец), содержащий от 5 до 30% Sb - непременный атрибут типографии! В чем же уникальность сплава, прошедшего сквозь века? Расплавленная сурьма, в отличие от других металлов (кроме висмута и галлия), при затвердевании расширяется, увеличивает свой объем. Таким образом, при отливке шрифта типографский сплав, содержащий сурьму, застывая в литейной матрице, расширяется, благодаря чему плотно ее заполняет и воспроизводит зеркальное изображение, которое переносится на бумагу. Кроме того, сурьма придает типографскому сплаву твердость и износостойкость, что важно при многократном использовании шаблона (матрицы, типографской формы).
Сплавы свинца с сурьмой, применяемые в химическом машиностроении (для облицовки ванн и другой кислотоупорной аппаратуры) имеют высокую твердость и коррозионную стойкость. Наиболее известный сплав гартблей (содержание Sb от 5 до 15%) применяется для изготовления труб, по которым транспортируют агрессивные жидкости. Из этого же сплава делают оболочки телеграфных, телефонных и электрических кабелей, электроды, пластины аккумуляторов, сердечники пуль, дробь, шрапнель. Широкое применение (станкостроение, железнодорожный и автомобильный транспорт) нашли подшипниковые сплавы (баббиты), содержащие олово, медь, свинец и сурьму (Sb от 4 до 15%), они обладают достаточной твердостью, большим сопротивлением истиранию, высокой коррозионной стойкостью. Также сурьма добавляется к металлам, предназначенным для тонких и хрупких отливок.
Чистую сурьму используют для получения антимонидов (AlSb, CaSb, InSb), а так же, как добавку в производстве полупроводниковых соединений. Такой сурьмой легируют (всего 0,000001%) важнейший полупроводниковый металл - германий, чтобы улучшить его качества. Ряд ее соединений (в частности, с галлием и индием) - полупроводники. Сурьма применяется в полупроводниковой промышленности не только как леганд. Сурьму используют и при производстве диодов (AlSb и CaSb), инфракрасных детекторов, устройств с эффектом Холла. Антимонид индия применяют для построения датчиков Холла, для преобразования неэлектрических величин в электрические, в счетно-решающих устройствах, в качестве фильтра и регистратора инфракрасного излучения. Благодаря большой ширине запрещенной зоны AlSb применяют для построения солнечных батарей.
Разнообразна "деятельность" и соединений сурьмы. Например, трехокись (оксид) сурьмы (Sb2O3) применяется в основном как пигмент для красок, глушитель для эмали, протрава в текстильной промышленности, в производстве огнеупорных соединений и красок, ее используют также для изготовления оптического (просветленного) стекла, керамических эмалей.
Пятиокись сурьмы (Sb2O5) находит широкое применение в изготовление фармацевтических препаратов, в производстве стекла, керамики, красок, в текстильной и резиновой промышленности, в качестве составной части люминесцентных ламп дневного света (в люминесцентных лампах галофосфатом кальция активируют Sb). Трехсернистую сурьму используют в производстве спичек и в пиротехнике. Пятисеринстую сурьму применяют для вулканизации каучука (у "медицинской" резины, в состав которой входит Sb2S5, характерный красный цвет и высокая эластичность). Сурьма треххлористая (SbCl3) применяется для воронения сталей, чернения цинка, в медицине, в качестве протравы в текстильном производстве и как реактив в аналитической химии.
Ядовитый стибин или сурьмянистый водород SbH3 - применяется в качестве фумиганта для борьбы с насекомыми - вредителями сельскохозяйственных растений. Многие соединения сурьмы могут служить пигментами в красках, например, сурьмянокислый калий (K2O * 2Sb2O5) широко применяется в производстве керамики, краска "сурьмин", основу которой составляет трехокись сурьмы, применяется для окраски подводной части и надпалубных построек кораблей. Метасурьмянокислый натрий (NaSbO3) под названием "лейконин" используется для покрытия кухонной посуды, а также в производстве эмали и белого молочного стекла.
Производство
Сурьма довольно редкий элемент, в земной коре ее имеется не более 5∙10-5%, тем не менее, известно свыше ста минералов, содержащих этот элемент. Распространенный и имеющий полупромышленное значение минерал сурьмы (не сульфид) - сурьмяный блеск, или стибнит, Sb2S3, содержащий свыше 70% сурьмы. Остальные сурьмяные руды резко отличаются друг от друга по содержанию в них металла - от 1 до 60%. Получать металлическую сурьму из руд, в которых меньше 10% Sb, нецелесообразно. По этой причине бедные руды обогащаются.
Сульфидные (самые богатые), а также комплексные руды обогащают флотацией, а сульфидно-окисленные - комбинированными методами. Пройдя обогащение, рудный концентрат содержит от 30 до 60% Sb, такое сырье пригодно для переработки в сурьму, что и производится пирометаллургическим или гидрометаллургическим методами. В первом варианте преобразования протекают в расплаве под воздействием высокой температуры, во втором - в водных растворах соединений сурьмы и других элементов. К пирометаллургическим методам получения сурьмы относятся: осадительная, восстановительная и прямая плавка в шахтных печах. Осадительная плавка, сырьем для которой является сульфидный концентрат, основана на вытеснение сурьмы из ее сульфида железом:
Sb2S3 + 3Fe → 2Sb + 3FeS
Происходит процесс в отражательных или вращающихся барабанных печах следующим образом: железо в виде чугунной либо стальной стружки вводят непосредственно в печь, далее для образования восстановительной атмосферы, которая предотвращает потери с выходом летучего оксида сурьмы (III), в шихту добавляют древесный уголь (каменноугольную мелочь или кокс). Для ошлакования пустой породы в шихту вводят флюсы - сульфат натрия или соду. Плавка шихты происходит при постоянной температуре 1 300-1 400oC. В результате осадительной плавки образуется черновая сурьма, содержащая от 95 до 97% Sb (зависит от первоначального содержания в концентрате) и от 3 до 5% примесей - железа, золота, свинца, меди, мышьяка и других металлов, которые содержались в исходном сырье. Извлечение сурьмы из первоначального концентрата составляет от 77 до 92%.
Восстановительная плавка основана на восстановлении окислов сурьмы до металла твердым углеродом:
Sb2O4 + 4C → 2Sb + 4CO
Производится в отражательных либо коротких барабанных печах при температуре 800-1 000oС. Шихту составляют окисленная руда, древесный уголь (возможна каменноугольная пыль) и флюс (сода, поташ). Получается черновая сурьма более чистая, чем при осадительной плавке (более 99% Sb), извлечение металла из концентрата составляет 80-90%.
Прямая плавка в шахтных печах применяется для выплавки металла из окисленного или сульфидного крупнокускового сырья. Максимальная температура 1 300-1 500oС достигается горением кокса - составной части шихты, в качестве флюса выступают известняк, пиритные огарки или железная руда. Металл получается как за счет восстановления углеродом (углем) коксом Sb2O3, так и в результате взаимодействия не окислившегося антимонита с Sb2O3 при постоянном удалении SO2 из расплава печными газами. Продукты плавки (черновой металл и шлак) стекают в нижнюю часть печи и выпускаются из него в отстойник.
Другой метод получения сурьмы - гидрометаллургический находит все большее применение последнее время. Он состоит из двух стадий: обработка сырья с переводом в раствор соединений сурьмы и выделение сурьмы из этих растворов. Сложность метода заключается в том, что перевести сурьму в раствор проблематично: большинство природных соединений сурьмы в воде не растворяется. Однако нужный растворитель был найден - водный раствор сернистого натрия (120 г/л) и едкого натра (30 г/л). Сульфид и окись сурьмы переходит в раствор в виде сульфасолей и солей сурьмяных кислот. Из полученного раствора сурьму выделяют электролизом. Черновая сурьма, полученная гидрометаллургическим методом, не отличается чистотой и содержит от 1,5 до 15% примесей.
Для получения сурьмы с меньшим количеством примесей применяют пирометаллургическое (огневое) или электролитическое рафинирование. Наиболее распространенное в промышленности огневое рафинирование производится в отражательных печах. При добавлении к расплавленной черновой сурьме стибнита, примеси железа и меди образуют сернистые соединения и переходят в штейн. Мышьяк удаляют в виде арсената натрия при плавке в окислительной атмосфере (продувка воздухом) содой или поташом, при этом удаляется и сера.
При наличии благородных металлов применяют анодное электролитическое рафинирование, позволяющее сконцентрировать благородные металлы в шламе. Рафинированная сурьма содержит уже не более 0,5-0,8% чужеродных примесей. Однако и такой металл удовлетворяет не всех потребителей - для полупроводниковой промышленности, например, требуется сурьма 99,999% чистоты. В таком случае применяют кристаллофизический метод очистки - зонную плавку в атмосфере аргона, в особо ответственных случаях, зонную плавку повторяют несколько раз.
Физические свойства
Сурьма известна в кристаллической форме и трех аморфных модификациях (взрывчатая, черная и желтая). По внешнему виду кристаллическая, или серая, сурьма (ее основная модификация) - блестящий металл серебристо-белого цвета с синеватым оттенком, который тем тоньше, чем больше примесей (чистый элемент в свободном состоянии образует игольчатые кристаллы, напоминающие форму звезд).
Многие механические свойства зависят от чистоты металла. Серая сурьма кристаллизуется в тригональной (ромбоэдрической) системе (а = 0,45064 нм, z = 2, пространственная группа R3m), ее плотность 6,61-6,73 г/см3 (в жидком состоянии - 6,55 г/см3). При давлении ~5,5 ГПа ромбоэдрическая решетка серой сурьмы переходит в кубическую модификацию SbII. При давлении 8,5 ГПа - в гексагональную SbIII. Выше 28 ГПа образуется SbIV. Плавится кристаллическая сурьма при невысокой температуре - 630,5oC, кипеть расплавленная сурьма начинает при 1 634oC.
Удельная теплоемкость сурьмы при температурах 20-100o С составляет 0,210 кдж/(кг * К) или 0,0498 кал/(г *oС), теплопроводность при 20oС равна 17,6 вт/(м * К) или 0,042 кал/(см * сек *oС). Температурный коэффициент линейного расширения для поликристаллической сурьмы 11,5 * 10-6 при температуре от 0 до 100oС; для монокристалла а1 = 8,1 * 10-6, а2 = 19,5 * 10-6 при 0-400oС, удельное электросопротивление при 20oС составляет 43,045 * 10-6 см * см.
Сурьма диамагнитна, ее удельная магнитная восприимчивость равна -0,66 * 10-6. Твердость по Бринеллю для литого металла равна 325-340 Мн/м2 (32,5-34,0 кгс/мм2); модуль упругости 285-300; предел прочности 86,0 Мн/м2 (8,6 кгс/мм2). Температура перехода сурьмы в сверхпроводящее состояние 2,7 К. Серая сурьма имеет слоистую структуру, где каждый атом Sb пирамидально связан с тремя соседями по слою (межатомное расстояние 0,288 нм) и имеет трех ближайших соседей в другом слое (межатомное расстояние 0,338 нм). При обычных условиях устойчива именно эта форма сурьмы.
При резком охлаждении паров серой сурьмы образуется черная сурьма (плотность 5,3 г/см3), которая при нагреве до 400oС без доступа воздуха переходит в серую сурьму. Черная сурьма обладает полупроводниковыми свойствами. Желтая сурьма образуется при действии кислорода на жидкий стибин SbH3 и содержит незначительные количества химически связанного водорода. При нагревании, а также при освещении видимым светом желтая сурьма переходит в черную сурьму.
Взрывчатая сурьма внешне похожа на графит (плотность 5,64-5,97 г/см3) взрывается при ударе и трении. Данная модификация образуется при электролизе раствора SbCl3 в соляной кислоте при малой плотности тока, содержит связанный хлор. Взрывчатая сурьма при растирании или ударе с взрывом превращается в металлическую сурьму.
Однозначно утверждать, что сурьма - металл, нельзя. Еще средневековые алхимики причислили ее (впрочем, как и некоторые истинные металлы: цинк и висмут, например) к группе "полуметаллов", ведь они хуже ковались, а ковкость считалась основным признаком металла, кроме того, по алхимическим представлениям, каждый металл был связан с каким-либо небесным телом. К тому моменту все известные небесные тела были уже распределены (Солнце связывали с золотом, Луна олицетворяла серебро, Меркурий - ртуть, Венера - медь, Марс - железо, Юпитер - олово и Сатурн - свинец), следовательно, самостоятельных металлов, по мнению алхимиков, больше не существовало.
В отличие от большинства металлов, сурьма, во-первых, хрупка и истирается в порошок (это можно сделать в фарфоровой ступке фарфоровым пестиком), а во-вторых, хуже проводит электричество и тепло (при 0oC ее электропроводность составляет лишь 3,76% электропроводности серебра). В то же время, кристаллическая сурьма имеет характерный металлический блеск, выше 310oС становится пластичной, кроме того, монокристаллы высокой чистоты пластичны. С серной кислотой сурьма образует сульфат Sb2(SO4)3 и утверждает себя в металлическом качестве, а азотная кислота окисляет сурьму до высшего оксида, образующегося в виде гидратированного соединения xSb2O5 * уН2О, доказывая ее характер неметалла. Получается, что металлические свойства выражены у сурьмы довольно слабо, однако и свойства неметалла присущи ей далеко не в полной мере.
Химические свойства
Конфигурация внешних электронов атома сурьмы 5s25p3. В соединениях сурьма обнаруживает сходство с мышьяком, однако отличается от него выраженными металлическими свойствами, проявляет степени окисления +5, +3 и -3. В химическом отношении пятьдесят первый элемент малоактивен - на воздухе при комнатной температуре металлическая сурьма устойчива, начинает окисляться при температурах близких к точке плавления (~600oС) с образованием оксида сурьмы (III), или сурьмянистого ангидрида - Sb2O3:
4Sb + 3O2 → 2Sb2O3
выше температуры плавления сурьма загорается. Оксид сурьмы (III) - амфотерный оксид с преобладанием основных свойств, нерастворим, образует минералы. Реагирует со щелочами и кислотами, причем в сильных кислотах, например серной и соляной, оксид сурьмы (III) растворяется с образованием солей сурьмы (III), в щелочах с образованием солей сурьмянистой H3SbO3 или метасурьмянистой HSbO2 кислоты:
Sb2O3 + 2NaOH → 2NaSbO2 + Н2О
иSb2O3 + 6HCl → 2SbCl3 + 3H2O
При нагревании Sb2O3 выше 700oC в кислороде образуется оксид состава Sb2O4:
2Sb2O3 + O2 → 2Sb2O4
Sb2O4 одновременно содержит трех- и пятивалентную сурьму. В его структуре соединены друг с другом октаэдрические группировки [Sb(III)O6] и [Sb(V)O6]. Этот окисел сурьмы самый устойчивый.
Измельченная порошкообразная сурьма горит в атмосфере хлора, пятьдесят первый элемент активно реагирует и с другими галогенами, образуя галогениды сурьмы. С азотом и водородом у металлической сурьмы реакции не возникает, также как с кремнием и бором, углерод незначительно растворяется в расплавленной сурьме. С серой, фосфором, мышьяком и со многими металлами сурьма соединяется при сплавлении. Соединяясь с металлами, сурьма образует антимониды, например, антимонид олова SnSb, никеля Ni2Sb3, NiSb, Ni5Sb2 и Ni4Sb. Антимониды можно рассматривать как продукты замещения водорода в стибине (SbН3) атомами металла. Некоторые антимониды, в частности AlSb, GaSb, InSb, обладают полупроводниковыми свойствами.
Сурьма устойчива по отношению к воде и разбавленным кислотам. Так, например, в соляной кислоте и в разбавленной серной кислоте сурьма не растворяется. Не реагирует она и с фтористоводородной и плавиковой кислотами. Однако концентрированные соляная и серная кислоты медленно растворяют сурьму с образованием хлорида SbCl3 и сульфата Sb2(SO4)3. С концентрированной азотной кислотой образуется плохо растворимая β-сурьмяная кислота HSbO3:
3Sb + 5HNO3 → 3HSbO3 + 5NO + H2O
Сурьма растворяется в царской водке - в смеси азотной и винной кислот. Растворы щелочей и NH3 на сурьму не действуют, расплавленные щелочи растворяют сурьму с образованием антимонатов.
При нагревании с нитратами или хлоратами щелочных металлов порошкообразная сурьма со вспышкой образует соли сурьмяной кислоты. Практический интерес представляют труднорастворимые соли сурьмяной кислоты - антимонаты (MeSbO3 * 3H2O, где Me - Na, К) и соли не выделенной метасурьмянистой кислоты - метаантимониты (MeSbO2 * 3H2O), обладающие восстановительными свойствами. Антимонаты (III) щелочных металлов, в особенности калия, растворимы в воде, в отличие от остальных антимонатов.
При нагревании на воздухе окисляются до антимонатов (V). Известны метаантимонаты (III), например КSbО2, ортоантимонаты (III), как Na3SbO3, и полиантимонаты, например NaSb5O8, Na2Sb4O7. Для редкоземельных элементов характерно образование ортоантимонатов LnSbO3, а также Ln3Sb5O12. Антимонаты никеля, марганца - катализаторы в органическом синтезе (реакции окисления и поликонденсации), антимонаты редкоземельных элементов - люминофоры.
Из важных соединений сурьмы, кроме оксида (III) выделяют также: гидрид (стибин) SbН3 - бесцветный ядовитый газ, образующийся действием HCl на антимониды магния или цинка или солянокислого раствора SbCl3 на NaBH4. Стибин медленно разлагается при комнатной температуре на сурьму и водород, процесс значительно ускоряется при нагреве до 150oC; он окисляется, горит на воздухе; мало растворим в воде; используют для получения сурьмы высокой чистоты. Другое важное соединение пятьдесят первого элемента - оксид сурьмы (V) или сурьмяный ангидрид, Sb2O5 (желтые кристаллы, растворяется в воде, образуя сурьмяную кислоту) обладает главным образом кислотными свойствами.
Что интересно, низший оксид сурьмы (Sb2O3) называют сурьмянистым ангидридом, хотя это утверждение неверно, ведь ангидрид является кислотообразующим окислом, а у Sb(OH)3, гидрата Sb2O3, основные свойства явно преобладают над кислотными. Таким образом, свойства низшего окисла сурьмы говорят о том, что сурьма - металл. Однако, высший окисел сурьмы Sb2O5 - это действительно ангидрид с четко выраженными кислотными свойствами, что говорит в пользу того, что сурьма все же - неметалл. Получается, что дуализм, наблюдаемый в физических характеристиках сурьмы, так же прослеживается и в ее химических свойствах сурьмы.
С использованием материалов веб-сайта http://i-Think.ru/

Антимонит. Округ Уайт-Кэпс Майн, шт. Невада, США. Фото: © А.А. Евсеев.
ДОПОГ 6.1 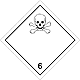
Токсичные вещества (яд)
Риск отравления при вдыхании, контакте с кожей или проглатывании. Составляют опасность для водной окружающей среды или канализационной системы
Использовать маску для аварийного оставления транспортного средства
Белый ромб, номер ДОПОГ, черный череп и скрещенные кости
ДОПОГ 8 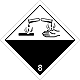
Коррозийные (едкие) вещества
Риск ожогов в результате разъедания кожи. Могут бурно реагировать между собой (компоненты), с водой и другими веществами. Вещество, что разлилось / рассыпалось, может выделять коррозийную пару.
Составляют опасность для водной окружающей среды или канализационной системы
Белая верхняя половина ромба, черная - нижняя, равновеликие, номер ДОПОГ, пробирки, руки
| Наименование особо опасного при транспортировке груза | Номер ООН | Класс ДОПОГ |
| СУРЬМА – ПОРОШОК | 2871 | 6.1 |
| Сурьма пятифтористая СУРЬМЫ ПЕНТАФТОРИД | 1732 | 8 |
| СУРЬМЫ ЛАКТАТ | 1550 | 6.1 |
| СУРЬМЫ ПЕНТАФТОРИД | 1732 | 8 |
| СУРЬМЫ ПЕНТАХЛОРИД ЖИДКИЙ | 1730 | 8 |
| СУРЬМЫ ПЕНТАХЛОРИДУ РАСТВОР | 1731 | 8 |
| СУРЬМЫ СОЕДИНЕНИЕ НЕОРГАНИЧЕСКОЕ ЖИДКОЕ, Н.З.К. | 3141 | 6.1 |
| СУРЬМЫ СОЕДИНЕНИЕ НЕОРГАНИЧЕСКОЕ ТВЕРДОЕ, Н.З.К. | 1549 | 6.1 |
| СУРЬМЫ ТРИХЛОРИД ТВЕРДЫЙ | 1733 | 8 |
| СУРЬМЫ-КАЛИЯ ТАРТРАТ | 1551 | 6.1 |
