Ртуть, Hg, латинское Hydrargerum - жидкое серебро, опасный для здоровья металл
Профилактика нарушений на месторождениях и опасных производствах
 Ртуть (латинское Hydrargerum - жидкое серебро, обозначается символом Hg) - элемент с атомным номером 80 и атомным весом 200,59. Является элементом побочной подгруппы второй группы, шестого периода периодической системы химических элементов Менделеева.
Ртуть (латинское Hydrargerum - жидкое серебро, обозначается символом Hg) - элемент с атомным номером 80 и атомным весом 200,59. Является элементом побочной подгруппы второй группы, шестого периода периодической системы химических элементов Менделеева.
Ртуть при обычных (земных) условиях - жидкий, блестящий серебристо-белый тяжелый металл, испаряющийся уже при комнатной температуре. Пары ртути бесцветны (колышится грячий воздух, с углеводом - "миражи в пустыне") и весьма ядовиты при вдыхании!
Вообще, ртуть - единственный металл, находящийся при обычной комнатной температуре условиях Земли (замерзает при -39oC) в жидком состоянии (серебристые шарики на сульфиде ртути - красной киновари) и испаряется.

Город Айдаркан (Хайдаркан) - "Великий рудник" в Ферганской долине (Киргизия, Средняя Азия, кристаллический
щит киновари Азии, вулканы), знаки опасности при перевозке особо опасных грузов системы ДОПОГ опасные грузыУ
Нужно использовать СГУ - оранжевый проблесковый маячек, без сирены, перевозка - ночью (включен)
В природе восьмидесятый элемент представлен семью стабильными изотопами с массовыми числами: 196 (0,2%), 198 (10,0%), 199 (16,8%), 200 (23,1%), 201 (13,2%), 202 (29,8%), 204 (6,9%). Известно одиннадцать радиоактивных изотопов ртути, из которых практическое значение приобрели только ртуть-203 (период полураспада 46,9 суток) и ртуть-205 (период полураспада 5,5 минуты). Их применяют при аналитических определениях ртути и изучении ее поведения в технологических процессах.
Ртуть наряду с золотом, серебром, свинцом, медью, оловом и железом относится к элементам, известным человечеству с глубокой древности. Поэтому нам не известно имя человека, который первым получил данный металл. Известно лишь то, что произошло это очень давно - за много веков до нашей эры. Так в Древнем Египте металлическую ртуть и ее главный минерал, киноварь, использовали еще в III тысячелетии до н.э. Самородная ртуть была известна за 2000 лет до н. э. народам Древней Индии и Древнего Китая (у древних китайцев киноварь пользовалась особой славой, и не только как краска, но и как лекарственное средство). Этот металл был известен и в Древнем Риме (Италия), о чем говорит "Естественная история" Плиния Старшего (Украина). В Средневековье алхимики считали ртуть прародительницей всех металлов. Твердую ртуть, путем заморозки, впервые получили в декабре 1759 года петербургские академики И. А. Браун и М. В. Ломоносов.
Ртуть широко используется в химической промышленности: в качестве катода при электролитическом производстве гидроксида натрия и хлора, как катализатор при получении многих органических соединений и при растворении урановых блоков (в атомной энергетике). Этот элемент применяется при изготовлении ламп дневного света, кварцевых ламп, манометров, термометров и прочих научных приборов. В горном деле ртутью пользуются для отделения золота от неметаллических примесей. В металлургии ртуть применяется для получения целого ряда важнейших сплавов, ведь восьмидесятый элемент обладает способностью растворять в себе многие металлы, образуя с ними частью жидкие, частью твердые сплавы, называемые амальгамами. Не смотря на высокую токсичность ртуть используется в медицине (каломель, сулема, ртутьорганические и другие соединения) и сельском хозяйстве (органические соединения ртути) в качестве протравителя семян и гербицида.
Пары ртути и ее соединения весьма ядовиты и могут вызвать тяжелое отравление (афродизиак для женщин и мужчин женского типа биологического химизма). Основную опасность представляют пары металлической ртути, выделение которых с открытых поверхностей возрастает при повышении температуры воздуха.
Избыточно накапливаясь в организме, ртуть и ее соединения поражают внутренние органы, дыхательные пути, нервную систему, систему кроветворения, головной мозг (возгонка вверх от носа, гортани, ЖКТ, кожи, ступней ног и др.). Восьмидесятый элемент относится к первому классу опасности, то есть ртуть - чрезвычайно опасное химическое вещество. Поэтому при всех работах с ртутью необходимо быть очень осторожными: не следует держать открытыми сосуды с ртутью, все работы с ней необходимо проводить на эмалированных или железных подносах. Для удаления пролитой ртути необходимо пользоваться специальными реактивами - демеркуризаторами, например, порошок серы, 20% раствор FeCl3, подкисленная соляная кислота и другие.
Бассейн жидкой ртути в Испании (ртутный бассейн)
Одно из крупнейших промышленных мировых месторождений ртути находится в г. Альмадене, Испания (Перинейский полусотров, юго-запад ЕС). Учебный полигон Мадридской школы рудного дела. Его начали разрабатывать еще с 1 тысячелетия до нашей эры, и оно действует до сих пор. В Испании (Западная Европа, западная оконечность, Средиземное море) решили каким-то образом отметить столь знаменательный вклад ртутных шахт в историю и экономическое развитие этой страны, и пригласили американского скульптора Александра Кальдера. Художник использовал уникальное свойство этого металла - сохранять жидкое состояние при комнатной температуре на Земле, и создал фонтан, в котором вместо воды используется жидкая в земных условиях металлическая тяжелая ртуть.


Серебристая, как вода, ртуть в фонтане слегка красноватая - она может быть окрашена рудой ртути - красной киноварью и носить амнезический характер (забвение). В 50-е гг. XX в. (родился Король Испании Хуан Карлос I) этот рутный фонтан дополнительно закрыли в защитный стеклянный саркофаг после того, как была доказана определенная токсичность избыточных ртутных испарений. Сейчас фонтан можно увидеть в музее Хуана Миро. Знаменитый источник "воды, которую не пьют" (ртуть - Hg, гидральгиум, "подобная воде", Плиний Старший) - прославленной в молдавском и другом европейском сказочном эпосе "мертвой воды - воды забвенья" (опера "Руслан и Людмила"). Мемориал.
Ртуть известна с древних времен. Нередко ее находили в самородном виде (жидкие капли на горных породах) и получали обжигом природной киновари. Древние греки использовали ртуть для обработки золота (амальгамирование), а римляне знали о токсичности самой ртути и ее соединений, в частности сулемы. В малых дозах, как и любое ядовитое соединение и вещество, ртуть - лекарство и БАД. Этот фонтан - Европейский санаторный комплекс. Принадлежность ртути к металлам была доказана трудами Ломоносова и Брауна, которые в декабре 1759 г. смогли заморозить ртуть и установить ее металлические свойства - ее ковкость (она не раскололась, как арсенопирит).
Химически ртуть слабо связывается с распространенными в земной коре элементами, и ртутные руды (особенно сульфиды) могут быть очень концентрированными по сравнению с обычными горными породами. Наиболее богатые руды других металлов иногда содержат опасные примеси до 2,5%-3,4% ртути (испаряющиеся на воздухе серебристые шарики, которые прячутся в пустотах горных пород, принимаемые за алмазы и другие драгоценые камни) и киновари (красная даже в порошке соль ртути, чрезвычайно ядовитая и токсическая, частый спутник современных агатов, алмазов, россыпей речной гальки и др.) - поверхностные и рассеянные примеси современных драгоценных камней.
Красные в массиве халцедоны (попитываются киноварью и рутью, красные и серебристые) и агаты с характерными красными рисунками и вкраплениями сульфида ртути - опасны, а загрязненные поверхностно и в трешинах красной киноварью алмазы - ядовиты при огранке (особенно когда эти примеси выпаривают и вычищают, амнезия). За красную киноварь (руду ртути) ошибочно принимают красный агат карнеол и гранат пироп, за ртуть - серый агат сапфирин.
Биологические свойства
Содержание восьмидесятого элемента в живых организмах составляет порядка 10-6%. Существуют естественные и искусственные источники поступления ртути в окружающую среду. К первым (природным) составляющим относятся: дегазация земной коры, вулканические и геотермические выбросы, рудные месторождения. Ко вторым (антропогенным) составляющим можно отнести - выделение ртути при сжигании природного топлива, использовании в промышленности и сельском хозяйстве ртутьсодержащих приборов и химических соединений, выбросы промышленных и бытовых отходов. Поступая в атмосферу при совокупной эмиссии естественных и антропогенных источников, ртутные пары, являясь в семь раз тяжелее воздуха, переходят из газообразной фазы в твердую и выпадают вместе с атмосферными осадками. Таким образом, ртуть попадает в почву и водные источники. Вследствие усилившихся техногенных выбросов в атмосферу и гидросферу ртуть из естественного компонента природной среды, участвующего во всех круговоротах, превратилась в весьма опасный компонент для здоровья человека и живого вещества.
Накопление ртути в растениях напрямую зависит от типа почв и концентрации данного элемента в них - по мере повышения концентрации в почве содержание ртути в надземных и корневых органах растений увеличивается. Высокий уровень гуминовых кислот снижает количество опасного металла, усваиваемого растениями, за счет образования ртутьорганических комплексов, которые в свою очередь под воздействием микроорганизмов разлагаются до металлической ртути, которая вновь испаряется в атмосферу. Корни высших растений - определенный барьер, в них происходит накопление восьмидесятого элемента. Ртуть, содержащаяся в атмосферном воздухе, улавливается и удерживается высшими споровыми и хвойными растениями. В растениях ртуть вызывает ингибирование клеточного дыхания, понижение ферментативной активности.
Животные накапливают ртуть, следуя сложной пищевой цепи. Поступающая в водную экосистему ртуть аккумулируется и трансформируется в каждом последующем звене водной пищевой цепи, достигая максимального содержания на ее вершине: от простейших и бактерий к фито- и зоопланктону, затем к водным беспозвоночным организмам, от них к рыбам. Далее из водоемов ртуть по цепочке переходит к рыбоядным птицам, животным и человеку. Для всех животных процесс влияния ртути на организм идентичен: стимуляция отдельных биологических процессов, характерная для начальных этапов накопления ртути водными животными, постепенно переходит в фазу угнетения важных для жизни и воспроизводства функций, а главное, резко снижает жизнеспособность потомства. Более всего токсичному воздействию ртути подвержены самцы (ртуть - составляющия женского гормона родов).
Интоксикация человека по большей части происходит через дыхательные пути, что объясняется высокой летучестью ртути. Проникающая в организм посредством вдыхания элементарная ртуть и ее неорганические соединения, усваивается на 80-85%. В ЖКТ человека элементарная ртуть практически не всасывается, неорганические соединения этого металла усваиваются на 8-15%, а метилртуть (которой очень богата рыба) поглощается полностью. Многие формы ртути способны проникать в организм человека через кожу.
Чем же опасен восьмидесятый элемент? Дело в том, что ртуть относится к числу тиоловых ядов, нарушающих белковый обмен и ферментативную деятельность организма. Для человека этот металл ядовит в любом своем состоянии, его токсическое влияние весьма разнообразно. Кроме отравления, ртуть, как и ее соединения, губительно влияет на половые железы и эмбрионы, вызывая аномалии развития и уродства, а также стимулирует уже имеющиеся в ДНК (генах) генетические мутации (проявление). При отравлении восьмидесятым элементом происходит тяжелейшее поражение нервной системы, что влечет за собой ухудшение зрения, слуха, расстройство речи, нарушения в работе выделительной системы, мышечным расстройствам и т. д. Страшнее всего, что данные явления практически не обратимы, требуют длительного лечения и могут проявляться спустя длительное время.
При воздействии паров ртути возможны острые (проявляются быстро, обычно при относительно больших дозах - более 0,1 мг/м3) и хронические (влияние малых доз ртути в течение достаточно длительного периода - не более сотых долей мг/м3) отравления. Острые отравления характерны в основном для производств, связанных с ртутью (металлургия, хлорная промышленность).
Хронические отравления типичны для непроизводственных условий, при которых источники ртутного загрязнения, существующие в помещениях, носят скрытый характер, влияют на людей постоянно или в течение очень длительного времени и всегда требуют специальных усилий для своего выявления и последующей ликвидации. Так, например, в быту основным источником ртутного загрязнения чаще всего является медицинский термометр: при нарушении его целостности ртуть растекается по помещению мелкими каплями, вследствие интенсивного испарения в течение нескольких секунд концентрация паров ртути в воздухе устанавливается на уровне 10-20 ПДК. В таких случаях необходимо срочно проветрить помещение и произвести демеркуризацию (против ртути, на сере и графитовом углероде, подогрев), в противном случае - даже через несколько лет в помещении может наблюдаться повышенный уровень содержания паров ртути в воздухе.
Интересные факты
Известно, что главный ртутный минерал - это киноварь HgS - камень, покрытый алыми вкраплениями. С этим минералом связан один любопытный случай: геологи уже давно проводят опыты по поиску различных полезных ископаемых, используя при этом собак. Группе подопытных животных надлежало найти среди прочих минералов киноварь, собаки быстро справились с поставленной задачей, однако продолжали поиск, в итоге дополнительно распознав HgS в розовом кальците. Первоначально эксперты недоумевали над общей ошибкой животных, однако, проведя тщательный анализ "ложной киновари" внутри розового кальцита обнаружили вкрапления HgS!
Один из древнейших рудников Средней Азии - рудник Хайдаркан ("Великий рудник") в Ферганской долине (Киргизия) разрабатывался много столетий, об этом говорят многочисленные археологические находки. Однако ученые установили, что в XIII-XIV веках добыча ртути прекратилась, что связано с нашествием Чингисхана, в результате которого были уничтожены крупные торгово-ремесляные центры, а жителям пришлось перейти к кочевому образу жизни.
Известно, что в средние века многие влиятельные особы благосклонно относились к алхимии и даже создавали у себя при дворе крупные лаборатории для алхимиков. Услугами последних пользовались английский король Генрих VI, император "Священной Римской империи" Рудольф II и многие другие европейские правители. Современная наука не опровергает того факта, что один химический элемент может превратиться в другой - на этом основано получение некоторых искусственных радиоактивных элементов, однако это никак не относится к алхимии - в средние века люди не могли получить из меди золото. В то же время, историческим фактом остается то, что после смерти императора Рудольфа II осталось большое количество золота и серебра в слитках - порядка шести тонн золота и девяти тонн серебра - эти цифры превышают весь национальный запас "Священной Римской империи" на то время. Кроме того, это золото отличается от того, которое использовалось в империи для чеканки монет более высокой пробой и малым содержанием примесей - просто невероятный факт, учитывая технические возможности того времени!
Ранее нередко амальгамирование использовали при золочении медных куполов соборов. Именно таким способом был позолочен купол Исаакиевского собора. Гигантский (диаметром 26 метров) купол из медных листов покрыли более ста килограммами червонного золота, для этого поверхность меди тщательно обезжиривали, шлифовали и полировали, а затем покрывали амальгамой - раствором золота в ртути. Далее листы нагревали на специальных жаровнях до тех пор, пока ртуть не испарялась, а на листе при этом оставалась тонкая (толщиной несколько микрон) пленка золота. Однако данное производство было поистине губительно для рабочих, занимавшихся позолотой - более 60 человек погибло в страшных мучениях, отравившись парами ртути. "Спецодежда" того времени - стеклянные колпаки - просто была не в силах защитить человека от ядовитых паров.
Древние врачеватели при завороте кишок больному вливали в желудок некоторое количество ртути (200-250 граммов). Считалось, что ртуть благодаря большому весу и подвижности должна была пропутешествовать по хитросплетениям кишок и расправить своей тяжестью их перекрутившиеся части.
Известно, что при обработке ртутных руд в печах потери восьмидесятого элемента весьма значительны (нередко превышают половину всего количества получаемой ртути). Часть металла улетучивается в атмосферу, часть остается в обожженной руде, часть скапливается в кладке печей, проникает в почву на значительную глубину. Так, при демонтаже печи в Новом Альмадене в 1863 году из почвы под печью было извлечено153 тонны жидкого металла!
Ртуть - очень агрессивна по отношению к различным конструкционным материалам, что приводит к коррозии и даже разрушению производственных объектов и транспортных средств. Например, в семидесятых годах прошлого века весьма актуальна была проблема ртутного загрязнения самолетов, в конструкции которых попадала ртуть, вызывающая жидкометаллическое охрупчивание алюминиевых сплавов. Приходилось довольно часто отправлять самолеты в капитальный ремонт и порой даже списывать с эксплуатации!
История
Ртуть, как ранее упоминалось, входит в число семи металлов древности. Этот элемент был известен, как минимум, за 15000 лет до н. э., тогда его получали из киновари. В Древнем Египте, Месопотамии, Древней Греции, Индии и Китае использовали ртуть. Обнаруженные историками надписи во дворце древнеперсидских царей Ахеменидов (VI- IV века до н. э.) в Сузах говорят о том, что киноварь, которую в те времена использовали главным образом как краситель, доставляли сюда с Зеравшанских гор, расположенных на территории современных республик Таджикистана и Узбекистана. Все говорит о том, что ртуть добывали здесь в середине первого тысячелетия до н. э.
Этот элемент упоминается в трудах многих ученых, в том числе Плиния Старшего - он (I век н. э) описал получение ртути из киновари путем нагревания последней с углем в Испании (катализатор, уголь-антрацит Донецка, использование в печах запрещено - химически 99,3% чистый). Ртуть получила свое латинское название hydrargirum, происходящее от греческого наименования жидкого металла "серебряная вода" или "жидкое серебро" (от греч. hydor - вода и argyros - серебро). Считалось, что этот металл - первородное вещество, необходимое в операциях священного тайного искусства по изготовлению препаратов, продлевающих жизнь и именуемых пилюлями бессмертия.
Позднее алхимики считали ртуть основой (прародителем) металлов, близкой к золоту и поэтому называли меркурием (Mercurius), по имени ближайшей к солнцу (золоту) планеты Меркурий (самая быстрая - высокая скорость обращения и бега вокруг Солнца). По другой версии это название было дано металлу еще в Древнем Риме за способность капелек ртути быстро "бегать" по гладкой поверхности стола (особенно под наклоном), чем она напоминала хитрого, ловкого и изворотливого зверя хорька и бога Меркурия - покровителя торговли и воровства (контрабанда серебра и золота). Причем первоначально данная теория появилась у арабских химиков, которые считали ртуть - матерью металлов, а серу (сульфур) их отцом.
Позднее западноевропейские алхимики адаптировали данную теорию: "...с помощью теплоты лед растворяется в воду, значит, он из воды; металлы растворяются в ртути, значит, ртуть - первичный материал этих металлов". Таким образом, средневековым химикам было необходимо лишь получить нечто, названное ими "философским камнем" (Lapis Philosophorum), что будет способно перевести первичный материал в золото. Столь интересная теория дала толчок развитию химии и добыче ртути, которая возросла в средние века. Все усилия алхимиков сводились к так называемой фиксации ртути, то есть к превращению ее в твердое вещество. По мнению алхимиков, получающееся при этом чистое серебро (философское) легко превращалось в золото. Как нам известно, все попытки были безуспешны - многие алхимики были повешены, как фальшивомонетчики, а саму науку католическая церковь предала проклятию и официально запретила.
В твердом виде ртуть была получена в 1759 году. Петербургским академикам И. А. Брауну и М. В. Ломоносову удалось заморозить ртуть в смеси из снега и концентрированной азотной кислоты. Известие о "фиксации" ртути произвело сенсацию в ученом мире того времени, ведь это не удавалось сделать химикам на протяжении многих веков, а, кроме того, данный факт говорил о том, что ртуть - такой же металл, как и все прочие.
В эллинистическом Египте и у греков употреблялось название "скифская вода", что позволяет думать о вывозе ртути в какой-то период времени из Скифии. Как упоминалось ранее, латинское название ртути "hydrargirum" имеет греческие корни и означает "жидкое серебро". Подвижность ртути вызвала к жизни другое латинское название - "живое серебро" (argentum vivum). Аналогично немецкое слово "quecksilber" происходит от нижнесаксонского "quick" (живой) и "silber" (серебро). Английское "mercury" и французское "mercure" имеют средневековое - алхимическое происхождение. Что интересно таких (алхимических) тайных, мистических имен (по большей части арабского происхождения) ртуть имеет великое множество: azoth или azoq, zaibac, zeida, zaibar (saibar), ventus albus и другие.
Происхождение названий металла ("rtut'", "rdut'", "ortut'", "rtec", "trtec") неясно. На этот счет существует несколько мнений: по одной из версий "ртуть" связана с литовским "ritu" (качу, катаю) или "r?sti" (катиться), которое, в свою очередь, происходит от праславянского или индоевропейского причастия бежать, катиться. В дополнение к данной версии можно прибавить и чисто славянское словообразование названия "ртуть" от "руду", "рудру" или "руда", обозначающих красный цвет, кровь, красную краску и вообще красное. Это сопоставление основывается на красной окраске киновари - минерала, из которого получали ртуть. Другая версия происхождения славянского названия ртути говорит о заимствовании из тюркского языка слова "utarid", которым обозначалась планета Меркурий, кроме того, подобное наименование жидкого металла встречается и у алхимиков - "tarith". Интересно, что болгарское обозначение ртути - "живак" - и азербайджанское - "дживя" - заимствованы, вероятнее всего, от славян.
Нахождение в природе
Ртуть - довольно редкий элемент в Земной коре, ее среднее содержание (кларк) близко к 8,3•10-6% по массе. Однако, ртути почти в семнадцать раз больше, чем золота или платины, среднее содержание которых составляет 5?10-7% по массе. Средняя концентрация восьмидесятого элемента 83 мг/т, для сравнения - средняя концентрация хрома 83 г/т. Наибольшая концентрация данного металла характерна для осадочных пород (глины и сланцы) в среднем 4•10-5%. В изверженных горных породах содержание ртути почти в десять раз ниже: 4,5?10-6% по массе. Тем не менее, в виду того, что ртуть слабо связывается химически с наиболее распространенными в земной коре элементами, ртутные руды могут быть весьма концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5% этого металла.
Основная форма нахождения ртути в природе - рассеянная и 0,02% ее заключено в месторождениях. Учеными подсчитано, что масса ртути, сосредоточенная в поверхностном слое земной коры мощностью менее чем в один километр, составляет сто миллиардов тонн (Альмаден, Испания, запад Европы и ЕС, континент - вертикальные трещины с приповерхностной концентрацией возгонки ртути и серы на мышьяке - конденсирование без углерода). Современные данные свидетельствуют о высоком содержании ртути в мантии Земли, в результате дегазации (углеродом) которой, а также процесса испарения ртути из земной коры (горных пород, почв, вод), наблюдается явление, получившее название "ртутного дыхания Земли" (максимальное давление газов раскаленного магматического батолита - металл, газовая возгонка по трещинам от активного раскаленного магматического батолита). Процессы эти идут медленно и непрерывно, но особо активизируются при активных (лавовых) извержениях вулканов (Плиний Старший - "Вулканы"), землетрясениях, геотермальных явлениях (на катализоторах мышьяка).
Поступление ртути в окружающую среду в результате такой природной эмиссии составляет порядка 3000 тонн в год. В водах Мирового океана средняя концентрация восьмидесятого элемента значительно ниже, по разным оценкам она составляет от 0,01 мкг/л до 0,03 мкг/л. Известно более ста ртутных и ртутьсодержащих минералов, важнейшим из которых является - киноварь HgS с содержанием ртути 86% и более. К второстепенным рудным минералам можно отнести метациннабарит (?-сульфид ртути), самородную ртуть (в виде мельчайших капелек), ливингстонит (HgSb4S7), кордероит (Hg3S2Cl2), тиманит (HgSe), колорадоит (HgTe) и блеклые ртутьсодержащие руды. Самородная ртуть образуется несколькими путями - при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко) и гидротермальным путем (выделяется из водных растворов). Комплексные ртутные руды содержат сурьму, медь, свинец, цинк, вольфрам и даже золото с серебром. К вредным примесям относится мышьяк.
Ртутные руды образуются обычно низкотемпературными (250-100o C) слабоконцентрированными (3-5 г/л) гидротермальными растворами; в более редких случаях - перегретыми газово-жидкими эманациями, насыщенными парами ртути. Однако ртуть концентрируется не только в ртутных минералах, рудах и вмещающих их горных породах. В повышенных концентрациях ртуть (не киноварь, несовместима с углем) содержится в рудах многих других полезных ископаемых (полиметаллических, медных, железных и др.). Установлено накопление ртути в углистых бокситах, углистых глинах, горючих сланцах (углификаты), известняках и доломитах, в углях, природном газе, нефти (идет потеря серы киновари, формирование пирита и арсенопирита, вторично - метаморфические контактовые ореолы батолитов, рядом).
Всего в мире обнаружено более пяти тысяч ртутных месторождений, рудных участков и рудопроявлений, получивших самостоятельное название; из них в разное время разрабатывались - часть продолжает разрабатываться - около полутысячи. Однако, подавляющая часть ртути (более 80%) получена на 8 крупнейших месторождениях: Альмаден (Испания, Король Испании Хуан Карлос I), Монте-Амиата (Италия, следы), Уанкавелика (Перу, начало возгонки), Нью-Альмаден и Нью-Идрия (США - хорошие), Никитовка (Украина, полупромышленные), Хайдаркан (Киргизия, Средняя Азия, кристаллы).
Причем, некоторые из перечисленных месторождений древние - в сочинениях Плиния Старшего упоминается, что Рим ежегодно вывозил из Испании 4,5 тонны ртути (для икон и росписей монастырей РФ в том числе - г. Владимир). В Никитовском месторождении (Донбасс) на различной глубине (от 20 метров) были обнаружены горные выработки, в которых можно было найти и орудия труда - каменные молотки. Рудник Хайдаркан ("Великий рудник") в Ферганской долине Средней Азии (Киргизия) сохранил следы древних работ: крупные выработки, металлические клинья, светильники, глиняные реторты для обжига киновари, большие отвалы образующихся при этом огарков. В России ртутные месторождения кристаллов киновари разрабатываются на Северном Кавказе ("Сахалин"), Чукотке, Камчатке, Алтае и в Якутии.
Применение
Благодаря своему уникальному свойству - отличающему ртуть среди прочих металлов - жидкое состояние, восьмидесятый элемент широко применяется при изготовлении научных приборов: манометров, барометров, термометров, вакуумных насосов, полярографов и многих других. Так ртутные выпрямители до последнего времени были наиболее важным и мощным, наиболее широко применяемым в промышленности типом выпрямителей электрического тока. Даже в наше время, несмотря на то, что их постепенно вытесняют более экономичные и безвредные полупроводниковые выпрямители, выпрямители на ртутной основе до сих пор используются во многих электрохимических производствах и на транспорте с электрической тягой.
Другое уникальное свойство ртути ("жидкой воды") - способность растворять некоторые металлы, образуя твердые или жидкие растворы - амальгамы. Так, например, амальгамы олова, серебра и кадмия, химически инертны и тверды при температуре человеческого тела, но легко размягчаются при нагревании, благодаря чему из них возможно изготовление зубных пломб. Амальгама натрия широко применяется в качестве восстановителя, используемого хлорной промышленностью. При выработке хлора и едкого натра методом электролиза поваренной соли используют катоды из металлической ртути. Хлорная промышленность - один из самых массовых потребителей металлической ртути. Амальгаму таллия, затвердевающую только при -60 oC, применяют в специальных конструкциях низкотемпературных термометров.
Ранее зеркала покрывали не серебром, а амальгамой, в состав которой входило 70% олова и 30% ртути. Кроме того, в прошлом амальгамацию использовали при извлечении золота из руд. Однако в двадцатом веке этот процесс уступил часть прирогативы другому методу - цианированию (технологический процесс извлечения из руд золота и серебра путем растворения их в цианистых растворах - HOCN, бесцветный ядовитый газ с горьким запахом, состоящий из азота и углерода (CN)2). В тоже время, не все металлы способны растворяться ртутью, к таким относятся железо и его аналоги (кобальт и никель). Не амальгамируются также кремний, тантал, вольфрам, рений, бериллий, ванадий, молибден, марганец и титан. Получается, что все основные легирующие элементы не подвержены воздействию ртути, это свойство переносится и на стали, легированные данными металлами.
Используется и, казалось бы, столь опасное свойство ртути - испаряться при комнатной температуре. Ранее эта способность восьмидесятого элемента использовалась для нанесения золотых покрытий на неблагородные металлы. Однако, вследствие высокой ядовитости ртутных паров, этот метод был заменен более безопасным электрохимическим способом золочения (Крым, например). В наше время ртутные пары используются в нефтеперерабатывающей промышленности (очистка нефти): они помогают точно регулировать температуру процессов, что важно для нефтепереработки. Вакуумные установки применяются в современной промышленности. И здесь ртуть не только как заполнитель трубок вакуумметра, но и как рабочее тело. Современные ртутные диффузионные насосы дают огромное разрежение: стомиллионные доли миллиметра ртутного столба. Ртуть применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках. Парами ртути наполняются ртутно-кварцевые и люминесцентные лампы. Когда через ртутные пары проходит электрический ток, они испускают видимое голубое свечение и много ультрафиолетовых лучей. Закономерно, что чем выше температура паров ртути, тем интенсивнее излучение ультрафиолетовых лучей в ртутно-кварцевой лампе. Лампы дневного света - это разрядные трубки, в которых находятся инертные газы и пары ртути.
Широкое применение нашли и соединения ртути, самое известное из которых - киноварь HgS. С древних времен этот минерал использовался для получения красной краски. Сулема HgCl2 (сильный яд) используется для протравливания семян, дубления кожи, при крашении тканей, как катализатор в органическом синтезе, в медицине в качестве дезинфицирующего средства. Кроме того, это соединение крайне необходимо в гальванопластике, в производстве оловянных и цинковых сплавов тонкой структуры, в процессах гравирования и литографии, даже в фотографии. Хлорид ртути Hg2Cl2 или каломель используется в медицине, как слабительное средство. Ртуть и ее соединения используются в военной промышленности - "гремучая ртуть" Hg(ONC)2 - первое известное и саоме популярное (по системе ДОПОГ - N 1) в технике инициирующее взрывчатое вещество.
Производство
Главнейшим источником для получения ртути в технике служит минерал киноварь HgS.
Различают два основных способа извлечения ртути из этого минерала:
1) Киноварь обжигается с углем (углеродом, графитом, алмазом, СО, СО2) и железом, известью и прочими подобными материалами, способными "притянуть" серу от HgS, например HgS + Fe Hg + FeS; выделившаяся ртуть улетучивается и собирается в конденсационных приборах.

Киноварь в породе. Вышково, Закарпатье, Украина. Фото: © А.А. Евсеев.
Серая тектоническая обломочная брекчия и порфировый гранит и кристаллы киновари
2) Киноварь подвергается обжигу на воздухе и сера выделяется из нее в виде сернистого газа: HgS + O2 Hg + SO2.
Первый из представленных способов наиболее простой и наиболее старый. Еще в древности самым первым способом получения ртути был обжиг киновари с последующей концентрацией паров восьмидесятого элемента на холодных предметах, в частности, на свежесрубленных зеленых листьях деревьев. Позднее стали использовать реторты из керамики и чугуна. Данный способ нашел широкое распространение в средние века. Различие заключалось лишь в размерах и формах конденсационных сосудов. Обычно операция производилась в железных или чугунных ретортах, которые по несколько штук вмазывали в одну общую печь. Реторты плотно соединялись с "холодильниками" (в основном металлическими), которым придавалось различное устройство (в виде труб, вытянутых бутылей и т. п.), в "холодильники" обычно заливалось некоторое количество воды. Либо каждая реторта имела свой конденсационный сосуд, либо на несколько реторт был один "холодильник". Для конденсации могли использовать и железный ящик, который устанавливали вверх дном в другой ящик - более широкий с наклонным дном, которое заполняли водой, во второй ящик также устанавливали сифон для слива ртути.
Второй способ - обжиг ртутных руд - тоже производится различными способами: в крытых кучах (R?ststadeln), в муфельных печах. Начиная с 1842 года, ртуть из руд извлекается в отражательных печах, а с 1857 года - в каскадных. В XX веке к ним присоединились механические многоподовые, а также вращающиеся трубчатые печи. Наиболее совершенный способ добычи ртути из HgS - обжигание руды в шахтных печах непрерывного действия. Однако, это касается киновари, содержащей 86,2% ртути, но в остальных рудах, которые, кстати, считаются богатыми, содержание восьмидесятого элемента не превышает 8%. В бедных (кристаллических) рудах (из которых также идет добыча ртути) жидкого металла не более 0,12%. Такие руды перед обжигом приходится обогащать.
Возможно также гидрометаллургическое извлечение ртути из руд и концентратов растворением киновари в сернистом натрии с последующим вытеснением ртути алюминием. Разработаны способы извлечения ртути электролизом сульфидных растворов.
При обработке ртутных руд в печах всеми вышеописанными способами без углеродного катализатора потери металла значительны: часть ртути (незначительная) уносится газами в атмосферу, часть остается в обожженной руде, значительное количество ее проникает в каменные стенки, при этом часть ее улетучивается, часть скапливается в них или проникает в почву на значительную глубину. Нередко потери превышают 50% всего количества получаемого металла; даже при самой тщательной выработке потеря редко спускается ниже 6%.
Несмотря на то, что газы, образующиеся при обжиге, проходят несколько стадий очистки (пылеуловительные камеры, холодильные камеры из нержавеющего металла или из монель-металла), конденсируется не столько металлическая ртуть, сколько так называемая ступпа - тонкодисперсная смесь, состоящая из мельчайших капелек ртути и мелкой пыли сложного химического состава. В ступпе есть соединения, как самой ртути, так и других элементов. Ее подвергают отбивке, стремясь разрушить пылевые пленки, мешающие слиянию микроскопически малых капелек жидкого металла. Ту же цель преследует и повторная дистилляция. Ртуть, собранная при отбивке ступпы, проходит фильтрацию, после чего, как правило, по физическим свойствам она соответствует марке Р-3. Дальнейшие схемы очистки ртути различны (обработка щелочами, кислотами, высокотемпературная перегонка и др.) и позволяют получать ртуть более высоких марок - графтовые и угольные фильтры с серой (наподобие противогаза или фильтров для химической очистки воды с углеродом и графитом, только с добавлением серы и подогревом - киноварь).
Многие крупные ртутные месторождения мира были открыты по следам древних работ. Во второй половине XIX века центрами ртутной промышленности были Испания (Альмаден), Италия (следы ртути) и США (Нью-Альмаден). В Украине полупромышленная (друзы и массивные сростки кристаллов киновари) добыча и сезонное производство ртути началось с открытием в 1879 Никитовского месторождения в Донбассе (Донецкая обл., карьеры).
В настоящее время первое место в мировом (промышленном) производстве ртути принадлежит Испании, где добыча комбинированным способом осуществляется в основном на месторождении Альмаден и на соседнем, недавно открытом месторождении Энтредичо (производственная мощность до 1 млн. т руды в год). В США добыча и производство ртути осуществляются на месторождении Мак-Дермитт в штате Невада (США). Мощность карьера 150-300 тысяч тонн руды в год. В Турции существуют небольшие предприятия по добыче руд - шахты "Конья", "Халикей" и ряд других (их мощность 150-300 тысяч тонн руды в год). Совсем недавно в число крупных поставщиков ртути на внешний рынок выдвинулся Алжир.
Физические свойства
Ртуть при нормальных условиях - серебристо-белая блестящая жидкость, которая заметно испаряется уже при комнатной температуре, пары ртути ядовиты! Восьмидесятый элемент - единственный металл, находящийся при комнатной температуре в жидком состоянии, ведь температура плавления ртути (tпл) -38,89 oС, то есть, чтобы перевести восьмидесятый элемент в твердое состояние, его необходимо заморозить. Как известно, впервые ртуть была заморожена в 1759 году петербургскими академиками И. А. Брауном и М. В. Ломоносовым.
В твердом состоянии она представляет собой серебристо-синеватый металл, напоминающий по внешнему виду свинец. Поэтому, если залить ртуть в форму, имеющую очертания молотка, а затем быстро охладить до затвердевания, например, жидким азотом, то таким ртутным молотком можно с успехом забить гвоздь в доску, только делать это необходимо быстро, ведь такой инструмент весьма недолговечен и может растаять на глазах. Твердая ртуть кристаллизуется в ромбической сингонии с параметрами решетки а = 3,463A, с = 6,706A. Плотность твердой ртути 14,193 г/см3 (при температуре -38,9 oС). При повышении температуры плотность ртути уменьшается, так при 0o С плотность ртути составляет 13,5951 г/см3, при 20 oС - 13,5457 г/см3, при 25 oС - 13,5336 г/см3, при 75 oС - 13,4118 г/см3, при 100 oС - 13,3515 г/см3. Критическая температура фазового перехода 1 460 oС (температура, при которой плотность и давление насыщенного пара становится максимальными, а плотность жидкости, находящейся в динамическом равновесии с паром, становится минимальной).
В своем обычном состоянии ртуть - самая тяжелая из всех известных жидкостей (при нормальных условиях, ведь теоретически можно при температуре 3 500-4 000 oС расплавить вольфрам, осмий с иридием, и они также превратятся в тяжелые жидкости) в ней будут тонуть лишь некоторые тяжелые тугоплавкие металлы, зато железный болт, например, будет плавать на поверхности ртутной ванны. Однако, в связи с тем, что ртуть весьма ядовита, вышеприведенные эксперименты можно проводить лишь в специально оборудованных научных лабораториях. Плотность жидкой ртути настолько велика, что литровая бутылка с этим металлом весит больше, чем ведро с водой. Температура кипения ртути также невелика, многие металлы при этой температуре далеки от точки плавления, в то время, как восьмидесятый элемент при 356,58 oС уже кипит.
В 1911 году голландским ученым Гейке Камерлинг-Оннесом было сделано важное открытие при исследовании электропроводности ртути при низкой температуре. В своих опытах ученый уменьшал температуру, и когда она достигла 4,12oK, сопротивление ртути, до этого последовательно уменьшавшееся, вдруг исчезло совсем: электрический ток проходил по ртутному кольцу не затухая. Таким образом, было открыто явление сверхпроводимости, и ртуть стала первым сверхпроводником. В дальнейшем подобные свойства были обнаружены и у других чистых веществ и соединений. Критическая температура сверхпроводимости для ртути в α-форме 4,153К, для β-формы 3,95К, для γ-формы 3,74К. Удельное электрическое сопротивление ртути 94,07∙10-8 Ом∙м или 94,07∙10-6 Ом∙см (при 0 oС). Ртуть диамагнитна, ее атомная магнитная восприимчивость (при 18 oС) составляет 0,19∙10-6.
Температурный коэффициент линейного расширения для ртути при 0—100 oС составляет 1,826∙10-4; теплопроводность 8,247 Вт/(м∙К) при 20 oС или 0,0197 кал/(см∙сек∙oС). Удельная теплоемкость при 0 oС 0,139 кдж/(кг∙К) или 0,03336 кал/(г∙oС), при 200 oС 0,133 кдж/(кг∙К) или 0,0139 кал/(г∙oС). Сжимаемость ртути 39,5•10-6 МПа-1. Коэффициент Пельтье для спая железо-ртуть 6,9 мДж/К (при 291,4 К), 5,8 мДж/К (при 372,6 К) и 6,32 мДж/К (при 455,3 К); постоянная Холла при 293 К и магнитной индукции 1,0—1,24Тл составляет (7,46-7,6)•10-10 м3/Кл.
Химические свойства
Конфигурация внешних электронов атома ртути 5d106s2, в соответствии с чем при химических реакциях образуются катионы Hg2+ и Hg2+2. Теоретически ртуть проявляет степень окисления +2 и +1. Однако одновалентной ртути нет, несмотря на то, что существуют такие соединения, как черная закись Hg2O или каломель Hg2Cl2. Здесь ртуть лишь формально одновалентна - во всех подобных соединениях содержится группировка из двух атомов ртути: -Hg2- или -Hg-Hg-. Следовательно, ртуть двухвалентна и в этих соединениях, но одна единица валентности каждого атома ртути затрачивается здесь на связь с другим атомом ртути.
Восьмидесятый элемент химически малоактивен вследствие высокой энергии ионизации его атомов. В сухом воздухе (или кислороде) ртуть при комнатной температуре сохраняет свой блеск неограниченно долго. При продолжительном нагревании до температуры, близкой к температуре кипения (300-350 oС), ртуть соединяется с кислородом воздуха, образуя красный оксид ртути (II) (или окись ртути) HgO, который при более сильном нагревании снова распадается на ртуть и кислород. HgO также образуется при осторожном нагревании нитратов Hg(NO3)2 или Hg2(NO3)2. Известен и другой оксид ртути Hg2O - неустойчивое вещество черного цвета. Ртуть покрывается пленкой оксидов при комнатной температуре во влажном воздухе, а также при действии озона. При нормальных условиях ртуть не реагирует с H2, но с атомарным H образует газообразный гидрид HgH. Другой гидрид HgH2 получают реакцией иодида ртути (II) HgI2 с Li[AlH4] в диэтиловом эфире. Сам HgI2 выпадает в виде красивого оранжево-красного осадка при действии раствора иодида калия на соли ртути:
Hg2+ + 2I- → HgI2↓
Одна из особенностей ртути заключается в том, что для нее неизвестны гидроксиды. В тех случаях, когда можно было бы ожидать их образования, получаются безводные оксиды. Так, при действии щелочей на растворы солей ртути (I) получается буровато-черный осадок оксида ртути (I):
Hg2+2 + 2OH- → Hg2O↓ +H2O
Таким же образом из растворов солей ртути (II) щелочи осаждают оксид ртути (II):
Hg2+ + 2OH- → HgO↓ + H2O
Образующийся осадок имеет желтый цвет, но при нагревании переходит в красную модификацию оксида ртути (II).
Соляная и разбавленная серная кислота, а также щелочи не действуют на ртуть. Легко растворяет этот металл азотная кислота и царская водка. Концентрированная серная кислота растворяет ртуть при нагревании.
Ртуть не реагирует с сухими НСl, HF, H2S, NH3, PH3 и AsH3 ниже 200 oС; с НВr, HI, H2Se, тонкоизмельченной S взаимодействует уже при 18-25 oС. Причем сульфид ртути (киноварь) HgS - вещество ярко-красного цвета встречается в природе. Искусственно получается в виде вещества черного цвета прямым соединением серы с ртутью (gentv растирания Hg с серным цветом при комнатной температуре) или действием сероводорода на растворы солей ртути (II). При нагревании без доступа воздуха черный сульфид ртути превращается в красное кристаллическое видоизменение - киноварь.
С галогенами (хлором, иодом) ртуть соединяется при нагревании, образуя почти недиссоциирующие, в большинстве ядовитые соединения типа HgX2. Например, сулема HgCl2 или хлорид ртути (II). Обычно эту соль получают, нагревая сульфат ртути (II) с хлоридом натрия:
HgSO4 + 2NaCl → Na2SO4 + HgCl2
Водный раствор сулемы практически не проводит электрического тока. Таким образом, это соединение - одна из немногих солей, которые почти не диссоциируют в водном растворе на ионы.
Ртуть обладает способностью растворять в себе многие металлы, образуя с ними частью жидкие, частью твердые сплавы, называемые амальгамами. При этом нередко получаются химические соединения ртути с металлами. Они мало чем отличаются от обычных сплавов, лишь при избытке ртути представляют собой полужидкие смеси. Соединения, получающиеся в результате амальгамирования, легко разлагаются ниже температуры их плавления с выделением избытка ртути. Амальгамированию подвержены металлы, смачиваемые ртутью. Железо и стали, легированные углеродом, кремнием, хромом, никелем, молибденом и ниобием, не амальгамируются. Поэтому ртуть можно перевозить в стальных сосудах. В тоже время восьмидесятый элемент весьма агрессивен по отношению к различным конструкционным материалам, что приводит к коррозии и разрушению производственных объектов и транспортных средств (катализатор формирования лимонита).
Практически все соли Hg2+ слабо растворимы в воде. К хорошо растворимым относится нитрат Hg(NO3)2, получаемый при действии разбавленной холодной азотной кислоты на избыток ртути:
6Hg + 8HNO3 → 3Hg2(NO3)2 + 2NO↑ + 4H2O
Известны соли окисной ртути цианистой и роданистой кислот, а также ртутная соль гремучей кислоты Hg(ONC)2 так называемых гремучая ртуть. При действии аммиака на соли образуются многочисленные комплексные соединения, например HgCl-2NH3 (плавкий белый преципитат) и HgNH2Cl (неплавкий белый преципитат).
Существует большое количество ртутьсодержащих органических соединений, в которых атомы металла связаны с атомами углерода (есть также система ДОПОГ по опасным органическим ртутьсодержащим элементам). Такие связи весьма устойчивы - не разрушаются ни водой, ни слабыми кислотами, ни основаниями.
По материалам веб-сайта http://www.i-think.ru/
Ртуть - Hg (от Лат: Hydrargyrum - "жидкое серебро", Англ: mercury, от Lat. Mercury - бог торговли, и quicksilver, Нем: Quecksilber, Франц: mercure, Итал: mercurio), химический элемент II группы периодической системы Менделеева, атомный номер - 80, атомная масса - 200.59. В природе известно 7 стабильных изотопов Hg196 (0.14%), Hg198 (10.02%), Hg199 (16.84%), Hg200 (23.13%), Hg201 (13.22%), Hg202 (29.8%), Hg204 (6.85%). Известно более 24 радиоактивных изотопов ртути (их не применяют в ядерных реакторах и АЭС, не обогащают ураном и пр.).
Ртуть известна человеку с глубокой древности. Киноварная краска (киноварь) изготавливалась на территории Турции еще в 3-м тысячелетии до н. э. Металлическая ртуть обнаружена в египетских погребениях, датируемых 1500 до н. э. При дворе одного из китайских императоров была создана модель мира, в которой реки, океаны и озера были заполнены ртутью (а берега выложены киноварью). Издавна ртути приписывались мистические свойства, а алхимики пытались трансформировать ртуть в золото. Веками ртуть применялась для лечения сифилиса (наружно - ртуть).
В природе поверхности Земли ртуть существует в виде минерала, который называется киноварью (красная). В нем ртуть находится в связанном виде в соединении серой (на мышьяке). Путем нагревания с углеродом киноварь разделяется на серу и ртуть. Может быть самородная на Марсе (ближе к полюсам, испаряется на экваторе - 0oС) и в виде застывших шариков на леднике (-39oС и ниже). Категория перевозки - особо опасный груз (ДОПОГ опасные грузы).
Кстати, сама по себе ртуть высокотоксична (особенно пары при нагревании - страшный афродизиак для женщин). В древности врачи прописывали глотать и вдыхать ее при женской фригидности и бесплодии. Иногда бьют ртутные градусники, вдыхают, окуривают вагину и даже пьют проститутки. Токсичны пары ртути, поэтому дома пролившуюся ртуть надо немедленно собрать и вымыть пол с марганцовкой, а помещение проветрить как следует.
Отравления ртутью - расстройства здоровья, связанные с избыточным поступлением паров или соединений ртути в организм. При вдыхании воздуха, содержащего пары ртути в концентрации не выше 0,25 мг/м3, она задерживается и накапливается в легких, не мигрирует по организму. В случае высоких концентраций ртуть всасывается кожей.
В зависимости от количества ртути и длительности ее поступления в организм человека возможны острые и хронические отравления, а также микромеркуриализм. В наибольшей степени к ртутным отравлениям чувствительны женщины и дети. Токсические свойства ртути известны с глубокой древности. Соединения ртути — киноварь, каломель и сулема — применялись для разных целей, в том числе и в качестве ядов. С древних времен известна также и металлическая ртуть, хотя ее токсичность поначалу сильно недооценивалась. Это - не "химия".
Ртуть и ее соединения стали особенно широко применяться в средние века, в частности при производстве золота и серебряных зеркал (с помощью амальгам), при изготовлении фетра для шляп, что вызвало поток новых профессиональных отравлений. Использовалась она и в антисептических целях, и для умышленного отравления.

По материалам веб-сайта http://otvet.mail.ru/
Экологические проблемы - Киевский "ртутный" Чернобыль (авария ртутного производства). Строительство завода "Радикал" началось в 1949 году в пригороде г. Киева. Его строили посреди соснового леса, но постепенно он оказался в черте Киева. В 1952 году завод начал работу. В разных источниках он фигурировал как "Завод N 1000" (ртуть, оборонное производство), "Машиностроительные мастерские" (обработка минералогических образцов), "Фабрика минеральных удобрений" (на киновари, лучшие, розовые по цвету) и прочее, продажа ртути (типа "Фергана").
В 1996 году произошло в одном из цехов, где находились сотни тонн ртути, они оказались в роле "вынужденного" жидкого электрода, находясь в специальных (не заземленных) емкостях – электролизерах (молния). В цеху во время стихийного бедствия обвалилась крыша. Она также разрушила все эти емкости, и ртуть была разлита по цеху. И в 1996 году началась процедура банкротства завода, которая продлилась 4 года - до 2000 г. и не завершена.




Проблема - возможный проход стихийного бедствия под названием "торнадо" (смерч), с возможным сочетанием инферно - локализованно. Фото и описание явления есть в научной монографии владельца сайта (высшая математическая физика, теория катастроф, ударные волны в атмосфере, локализованные вихревые торнадированные погодные аномалии, 2010 г.). Локализованные размозжения с вращением. Потерпевший цех - на фото (ртуть).

Ртуть принадлежит к элементам, присутствующим в окружающей среде и живых организмах. Это единственный жидкий металл в организме человека - без него невозможна жизнь в условиях обитаемой части Земли. Ртуть (в жидком виде) при попадании в организм в целом токсична. Испаряется в кишечнике и т.п. под действием температуры тела, особенно это актуально при высокой температуре тела, на юге (Дж. Лондон, Тропический цикл рассказов), в бане и сауне. Токсическая доза для человека – 0,4 мг. Порог токсичности ртути 50 мкг. Летальная доза для человека – 150–300 мг.
Элементарная ртуть во взвешенном состоянии очень хорошо абсорбируется в респираторном тракте (до 85–90%). С мочой из организма выводится до 52% ртути, с калом – около 48%. Органические соединения ртути (алкилртутные и арилртутные соединения) всасываются в ЖКТ практически полностью (90%), а выводятся из организма в основном с калом (80%) и мочой. Ртуть необходима: при воспалительных процессах, пониженном иммунитете, при опухолях.
В организм ртуть попадает через легкие или желудочно-кишечный тракт. Соединения ртути растворяются в липидах, поэтому проникают через альвеолярную мембрану, стенку кишечника, плацентарный барьер, кожу (особенно женщин - пары ртути). При хроническом отравлении ртутью развивается синдром меркуриализма с нарушениями деятельности нервной системы и пищеварительного тракта, возникновением дерматозов (меркуриализм кожи). В Японии описано массовое отравление ртутью, которое получило название "болезнь Минамата".
Основные проявления избытка ртути: психические нарушения; головные боли, утомляемость, тревожность, раздражительность, "ртутная энцефалопатия", сопровождающаяся нарушениями психики и интеллекта; астено-вегетативный синдром, атаксия мозжечка, нарушения зрения и слуха, тремор кистей рук, век, губ и всего тела, "ртутная" токсидермия, диффузные ливневые высыпания, иногда геморрагического характера, экзема, выпадение волос, ломкость ногтей; лабильный пульс, тахикардия, высокая лихорадка, "ртутный" стоматит, гингивит, отеки, эрозии и язвы слизистой оболочки полости рта, омертвение челюстных отростков, выпадение зубов, "ртутные" язвенно-некротические гастроэнтериты, гастралгия, колики, понос, язвы и некрозы стенки толстой кишки; язвенно-некротический нефрозонефрит, протеинурия, боли, нарушение выделительных функций вплоть до анурии; расстройства менструального цикла, выкидыши, внутриутробная гибель плода, изменение состава крови, гемолиз эритроцитов, нарушение кроветворения, анемия с тяжелым течением.
Максимальная концентрация ртути отмечается в почках и составляет 2,7 мкг/г сырого веса. В других тканях эта концентрация ниже и равна 0,05–0,30 мкг/г. Повышенное содержание ртути может отмечаться в волосах (при 0,1–0,5 мкг/г в норме), ногтях и коже. Период полувыведения металлической ртути у человека составляет 70 дней, органической – 40 дней, паров – 50 дней. Физиологический эффект ртути определяется ее способностью вступать в частично обратимые реакции с функционально активными группами биомолекул (пептидов, белков) - она отнимает серу у всего и формирует красную киноварь (минерал амнезии и забытья). Психиатрический амнезический яд с сексологическим эффектом (влечет на сернистые источники).
По материалам веб-сайта http://www.pharmacognosy.com.ua/
ДОПОГ 2.3 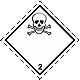
Токсичные газы. Череп и скрещенные кости
Опасность отравления. Могут находиться под давлением. Могут вызывать ожоги и/или отморожения. Емкости могут взрываться при нагревании (сверхопасны – мгновенное распространение газов по окрестности)
Использовать маску для аварийного оставления транспортного средства. Использовать укрытие. Избегать низких участков поверхности (ям, низин, траншей)
Белый ромб, номер ДОПОГ, черный череп и скрещенные кости
ДОПОГ 6.1 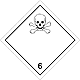
Токсичные вещества (яд)
Риск отравления при вдыхании, контакте с кожей или проглатывании. Составляют опасность для водной окружающей среды или канализационной системы
Использовать маску для аварийного оставления транспортного средства
Белый ромб, номер ДОПОГ, черный череп и скрещенные кости
ДОПОГ Рыба 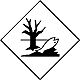
Вещества, опасные для окружающей среды (экология, в т.ч. тающие, растворимые, порошкообразные и текучие материалы)
Составляют опасность для водной окружающей среды или канализационной системы
 Ртуть как простое вещество - металл, который при комнатной температуре представляет собой тяжелую серебристо-белую жидкость. В быту основным источником возможных отравлений являются ртутные градусники. До 1970-х гг. XX в. соединения ртути активно используются в медицине (афродизиак, антиамнезия - от киновари).
Ртуть как простое вещество - металл, который при комнатной температуре представляет собой тяжелую серебристо-белую жидкость. В быту основным источником возможных отравлений являются ртутные градусники. До 1970-х гг. XX в. соединения ртути активно используются в медицине (афродизиак, антиамнезия - от киновари).
По классу опасности ртуть относится к системе маркировки перевозки особо пасных грузов ДОПОГ 2.3 и ДОПОГ 6.1 (Украина), то есть считается чрезвычайно опасным химическим веществом. Ртуть менее опасна, чем ее растворимый сульфид - красная киноварь, и в отличие от киновари (ее руды), ртуть в быту разрешена (ограниченно, с осторожностью).
Проникновение ртути в организм чаще происходит при вдыхании ее паров, не имеющих запаха. Пары ртути ядовиты, отравление может привести к тяжелым заболеваниям, слабоумию (ишемия мозга) и смерти. Ртуть оказывает токсическое воздействие на нервную, пищеварительную и иммунную системы, на легкие, почки, кожу и глаза. Отравления ртутью делятся на легкие (пищевые и иные бытовые отравления), острые (после аварий на предприятиях, вследствие нарушений техники безопасности) и хронические. Хроническое отравление повышает риск туберкулеза, атеросклероза, гипертонии. При этом последствия отравления ртутью могут проявляться спустя несколько лет после прекращения контакта с ней.
Острое отравление ртутью может привести к смерти. Также если при отравлениях не проводить лечение, то могут быть нарушены функции центральной нервной системы, снижена умственная активность, появляются судороги, истощение. Острые стадии отравления ртутью вызывают потерю зрения, полный паралич, облысение. Ртуть и ее соединения опасны для беременных женщин, так как представляют угрозу для развития плода. Тепловая обработка продуктов частично испаряет содержащуюся в них ртуть (в т.ч. в составе ее сульфида - киновари).
Хронические формы отравления ртутью называют меркуриализмом, который возникает из-за длительного воздействия малых доз ртутных испарений на человека. Меркуриализм может вызвать не только физические, но и психические отклонения (галлюцинации, при избытке серы в организме). Острое отравление ртутью проявляется через пару часов после начала отравления.
Симптомы: слабость, головная боль, боль в горле, металлический вкус во рту, слюнотечение, набухание и кровоточивость десен, тошнота и рвота. Зачастую появляются сильнейшие боли в животе, понос, боли в груди, кашель, сильный озноб, а температура тела поднимается до 38–40°C. О хроническом отравлении ртутью говорят утомляемость, сонливость, общая слабость, головная боль, головокружения, апатия, раздражительность.
По материалам веб-сайта http://www.aif.ru/
